
题目列表(包括答案和解析)
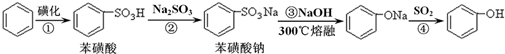
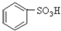 B.
B.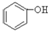 C.H2SO3
C.H2SO3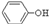 外、可能还含有OH-、S
外、可能还含有OH-、S| O | 2- 3 |
| O | - 3 |
 、S
、S| O | 2- 3 |
| O | - 3 |
| 实验步骤 | 预期现象和结论 | ||
| 步骤1:取少量待测液于试管中,加入足量的1mol?L-1BaCl2溶液,静置、过滤,得滤液和沉淀.将滤液分置于试管A、B中,沉淀置于试管C中. | |||
| 步骤2:往试管A中加入 |
| ||
| 步骤3:往试管B中加入 |
|||
| 步骤4:往试管C中加入2mol?L-1盐酸酸化,再滴入1~2滴品红溶液. |
|
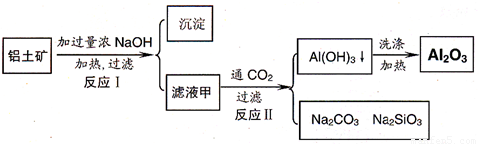
铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料.提取氧化铝的工艺流程如下:
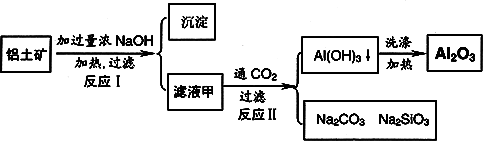
(1)滤液甲的主要成分是(写化学式)________
(2)写出反应Ⅱ的离子方程式:________
(3)结合反应Ⅱ,判断下列微粒结合质子(H+)的能力,由强到弱的顺序是________(填字母序号)
a.AlO2―或[Al(OH)4]-
b.OH―
c.SiO32―
(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失.沉淀消失的原因可用离子方程式表示为:________
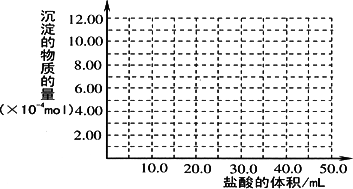
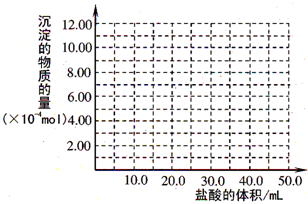
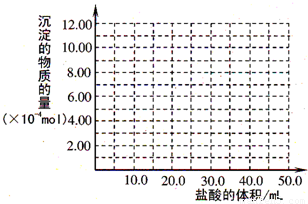
(5)取(4)电解以后的溶液10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol·L-1盐酸溶液,当加入50.0 mL盐酸溶液时,生成的沉淀恰好溶解.
①加入50.0 mL盐酸溶液发生的离子反应的先后顺序依次为:________.
②请画出生成沉淀的物质的量与加入盐酸体积的关系图.


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com