
题目列表(包括答案和解析)
+ 4 |
(5分)氰[(CN)2]为无色可燃气体、剧毒、有苦杏仁味,是拟卤素的一种。拟卤素的性质与卤素相似。
(1)写出氰与苛性钠溶液反应的化学方程式: 。
(2)已知氰分子中键角为180°,分子具有对称性,(CN)2的结构式为 ,(CN)2的分子为(填“极性”或“非极性”) 分子。
(3)CN-中电子数为 。
多原子分子氰(CN)2、硫氰(SCN)2和(OCN)2的性质与卤素单质相似,故称它们为拟卤素。它们可以生成酸和盐(见下表,表中X代表F、Cl、Br或I)。
| 卤素 | 氰 | 硫氰 | ① | |
| “单质” | X2 | (CN)2 | (SCN)2 | (OCN)2 |
| 酸 | HX | HCN | ② | HOCN |
| 盐 | KX | KCN | KSCN | ③ |
(1)在表中①②③空格处应分别填写_______、_______、_______。
![]() (2)完成下列反应的化学方程式或离子方程式。
(2)完成下列反应的化学方程式或离子方程式。
![]() ①(CN)2和KOH溶液反应的化学方程式为:______________。
①(CN)2和KOH溶液反应的化学方程式为:______________。
![]() ②已知阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-。试写出在NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式:____________________________________。
②已知阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-。试写出在NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式:____________________________________。
某小组同学设计实验探究Fe3+与Fe2+相互转化,实验方案及现象如下:
Ⅰ. 配制FeCl2溶液
取部分变质的氯化亚铁固体[含有难溶性杂质Fe(OH)2Cl],向其中加入稀盐酸,使其完全溶解,再加入适量铁粉。
Ⅱ. 实验探究Fe3+与Fe2+相互转化
实验1:
0.1 mol/L FeCl2溶液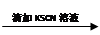 无明显现象
无明显现象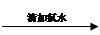 溶液变红
溶液变红
实验2:
0.1 mol/L FeCl3溶液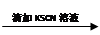 溶液变红
溶液变红 溶液红色未褪去
溶液红色未褪去
写出Fe(OH)2Cl与盐酸反应的离子方程式 。
(2)请用离子方程式解释实验1中滴加氯水后溶液变红的原因 。
(3)实验2的现象与预测不同, 为探究可能的原因,该小组同学又进行了如下实验,方案及现象如下:
步骤1:10 mL 0.1 mol/L KI溶液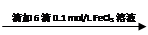 溶液明显变黄
溶液明显变黄
步骤2:将黄色溶液分为三份:
试管1 取2 mL黄色溶液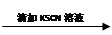 溶液变红
溶液变红
试管2 取3 mL黄色溶液 溶液变蓝
溶液变蓝
试管3 取3 mL黄色溶液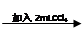 取上层溶液
取上层溶液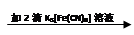 溶液变蓝(比试管2中溶液颜色深)
溶液变蓝(比试管2中溶液颜色深)
① 试管2中滴加K3[Fe(CN)6] 检验的离子是 。
② 黄色溶液中含有的溶质微粒有K+ 、Cl- 和 。
③ 综合上述实验现象,得出的实验结论是 。
4Au+8NaCN+2H2O+O2====4Na[Au(CN)2]+4NaOH
Na[Au(CN)2]在水溶液中电离为Na+和[Au(CN)2]-。
电离方程式为:
Na[Au(CN)2]====Na++[Au(CN)2]-
然后再用锌从溶液中把金置换出来,锌转化为Na2[Zn(CN)4]。
请回答下列问题。
(1)写出在空气中用氰化钠溶液提取金的电极反应式 ____________________________。
(2)写出锌从溶液中置换出金的离子方程式 ____________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com