
题目列表(包括答案和解析)
过氧化氢在催化剂作用下可快速产生氧气,它不仅是常用的消毒剂,还在航天和军事工业上有重要的用途。
(1)写出在过氧化氢溶液中加入MnO2粉末时,反应的化学方程式 。
(2)常用的消毒剂CH3COOOH(过氧乙酸),可以用冰醋酸和过氧化氢反应制取。制取时的化学反应方程式为 。该消毒剂中含有的少量过氧化氢,可以用它与高锰酸钾、次氯酸钠等强氧化剂的反应进行测定。请问,该消毒剂能否与漂粉精混合使用。
(3)过氧化氢和强还原剂液态肼(N2H4)可构成火箭推进剂。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 rnol液态肼与足量的过氧化氢反应,生成氮气和水蒸气,放出236.64kJ的热量。
①写出该反应的热化学方程式 。
②又知H2O(l)=H2O(g);![]() 44 kJ?mol
44 kJ?mol![]() ,则16 g液态肼与过氧化氢反应生成液态水时放出的热量是 kJ。
,则16 g液态肼与过氧化氢反应生成液态水时放出的热量是 kJ。
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有―个很大的优点是
| A、反应①中反应物所具有的总能量大于生成物所具有的总能量 | B、2N2H4(g)+2NO2(g)=3N2(g)+4H2O (g)△H=-1000.3kJ/mol | C、铂做电极,KOH溶液做电解质溶液,由反应②设计的燃料电池其负极反应式:N2H4-4e-+4OH-=N2+4H2O | D、铂做电极,KOH溶液做电解质溶液,由反应②设计的燃料,工作一段时间后,KOH溶液的pH将增大 |
乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇:
①2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
②2CO(g)+4 H2(g) ![]() CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
(1)写出反应①的平衡常数表达式K= 。
(2)条件相同时,反应①与反应②相比 ,转化程度更大的是 ;以CO2为原料合成乙醇的优点是 (写出一条即可)。
(3)在一定压强下,测得反应①的实验数据如下表。分析表中数据回答下列问题:
 | 500 | 600 | 700 | 800 |
1.5 | 45 | 33 | 20 | 12 |
2.0 | 60 | 43 | 28 | 15 |
3.0 | 83 | 62 | 37 | 22 |
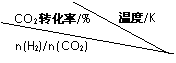
①温度升高,K值 (填“增大”、“减小”、或“不变”)。
②提高氢碳比[n(H2)/n(CO2)], K值 (填“增大”、“减小”、或“不变”),对生成乙醇
(填“有利”或“不利”)。
(4)在右图的坐标系中作图说明压强变化对反应①的化学平衡的
影响。并对图中横坐标、纵坐标的含义作必要的标注。
(5)肼(N2H4)与NO2反应生成N2和水蒸汽,比相同质量乙醇与
O2燃烧生成CO2和水蒸汽产生的热能更多,故肼常作为高能火箭燃料。
已知:N2 (g)+2O2(g)===2NO2(g) △H= +67.7kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(g) △H= —534.0kJ/mol
则肼与二氧化氮反应生成氮气和水蒸汽的热化学方程式为: 。
乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇:
①2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
②2CO(g)+4 H2(g) ![]() CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
CH3CH2OH(g)+H2O(g) 25℃时,K=1.71×1022
(1)写出反应①的平衡常数表达式K= 。
(2)条件相同时,反应①与反应②相比 ,转化程度更大的是 ;以CO2为原料合成乙醇的优点是 (写出一条即可)。
(3)在一定压强下,测得反应①的实验数据如下表。分析表中数据回答下列问题:
 | 500 | 600 | 700 | 800 |
1.5 | 45 | 33 | 20 | 12 |
2.0 | 60 | 43 | 28 | 15 |
3.0 | 83 | 62 | 37 | 22 |
①温度升高,K值 (填“增大”、“减小”、或“不变”)。
②提高氢碳比[n(H2)/n(CO2)], K值 (填“增大”、“减小”、或“不变”),对生成乙醇
(填“有利”或“不利”)。
(4)在右图的坐标系中作图说明压强变化对反应①的化学平衡的
影响。并对图中横坐标、纵坐标的含义作必要的标注。
(5)肼(N2H4)与NO2反应生成N2和水蒸汽,比相同质量乙醇与
O2燃烧生成CO2和水蒸汽产生的热能更多,故肼常作为高能火箭燃料。
已知:N2 (g)+2O2(g)===2NO2(g) △H= +67.7kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(g) △H= ―534.0kJ/mol
则肼与二氧化氮反应生成氮气和水蒸汽的热化学方程式为: 。
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时:正极的电极反应式是 。
负极的电极反应式是 。
(3)下图是一个电化学过程示意图。

①锌片上发生的电极反应是
。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com