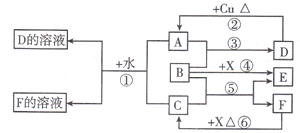
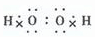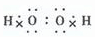A.B.C.D.E、F是中学化学中常见的气体,它们均由短周期元素组成,具有如下性质:
①B能使湿润的红色石蕊试纸变蓝,D、F不能使湿润的石蕊试纸变色;
②A能使湿润的蓝色石蕊试纸先变红,后褪色;将红热的铜丝放入装有A的瓶中,瓶内充满棕黄色的烟;
③将点燃的镁条放入装有E的瓶中,镁条剧烈燃烧,生成白色粉末,瓶内壁附着黑色颗粒;
④D是最简单的有机物;F是空气中含量最多的气体.
⑤实验室中可用浓的C溶液与某黑色固体共热制A气体.
回答下列问题:
(1)B的化学式为
NH3
NH3
,固态E可用作
致冷剂
致冷剂
(写一种重要用途)
(2)③中发生反应的化学方程式是
;
(3)⑤中发生反应的化学方程式是
MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O
MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O
;
(4)已知标准状况下体积为1.12L的D完全燃烧生成E和液态水时,放出热量44.5kJ,写出表示1molD燃烧的热化学方程式
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ/mol
.
(5)一定条件下,向废水中加入CH
3OH,将HNO
3还原成F.若该反应消耗16gCH
3OH转移3mol电子;该反应的化学方程式为
5CH3OH+6HNO3═5CO2+3N2+13H2O
5CH3OH+6HNO3═5CO2+3N2+13H2O
.