
题目列表(包括答案和解析)
一定条件下硝酸铵受热分解的化学方程式(未配平)为:NH4NO3- HNO3+N2+H2O,在反应中被氧化与被还原的氮原子数之比为:
A.5∶3 B.5∶4 C.1∶1 D.3∶5
【解析】被氧化化合价升高,即N原子从-3价升高到0价,失去3个电子。被还原,化合价降低,即N原子从+5价降低到0价,得到5个电子。所以根据得失电子守恒可知被氧化与被还原的氮原子数之比为5∶3,即答案是A。
一定条件下硝酸铵受热分解的化学方程式(未配平)为:NH4NO3 - HNO3+N2+H2O,在反应中被氧化与被还原的氮原子数之比为:
A.5∶3 B.5∶4 C.1∶1 D.3∶5
【解析】被氧化化合价升高,即N原子从-3价升高到0价,失去3个电子。被还原,化合价降低,即N原子从+5价降低到0价,得到5个电子。所以根据得失电子守恒可知被氧化与被还原的氮原子数之比为5∶3,即答案是A。
高温下,某反应达到平衡,平衡常数K=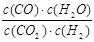 。恒容时,温度升高,H2浓度减小。下列说法正确的是
。恒容时,温度升高,H2浓度减小。下列说法正确的是
A.该反应是焓变为正值
B.该反应化学方程式为CO+H2O CO2+H2
CO2+H2
C.升高温度,逆反应速率减小 D.恒温下,缩小容器体积,H2浓度一定减小
【解析】根据平衡常数的表达式可以得出反应的方程式CO2+H2 CO+H2O,温度升高,氢气浓度减小,则平衡向正反应方向移动,所以反应是吸热反应,A正确。只要温度升高,反应速率就一定增大,反应前后体积不变,所以缩小容器容积,平衡不移动,但氢气浓度会增大,所以答案是A。
CO+H2O,温度升高,氢气浓度减小,则平衡向正反应方向移动,所以反应是吸热反应,A正确。只要温度升高,反应速率就一定增大,反应前后体积不变,所以缩小容器容积,平衡不移动,但氢气浓度会增大,所以答案是A。
(10分)下图是一个电化学过程的示意图。
请回答下列问题:
(1)图中甲池的名称 (填“原电池”“电解池”或“电镀池”)。
(2)写出通入CH3OH的电极的电极反应式: 。
(3)乙池中反应的化学方程式为 ,当乙池中B极的质量增加5.4g时,甲池中理论上消耗O2的体积为 L(标准状况下),此时丙池中 电极(填“C”或“D”)析出1.6g某金属,则丙池的某盐溶液可能是 (填序号)
A.MgSO4溶液 B.CuSO4溶液 C.NaCl溶液 D.AgNO3溶液
【解析】(1)甲属于燃料电池,给乙池和丙池供电。在燃料电池中可燃物在负极通入,所以电极反应式为CH3OH+8OH――6e-=CO32-+6H2O。电极A和电池的正极相连,所以A是阳极、B是阴极、C是阳极、D是阴极。A是惰性电极,所以乙池中反应式为4AgNO3+2H2O 4Ag+O2↑+4HNO3。5.4g是单质银,转移的电子是
![]() ,所以根据得失电子守恒可知氧气的物质的量是
,所以根据得失电子守恒可知氧气的物质的量是![]() 。金属阳离子只有在阴极放电,所以在D电极放电。镁和钠属于活泼的金属,在水溶液中其离子不可能放电。1.6g若是铜,则转移的电子为
。金属阳离子只有在阴极放电,所以在D电极放电。镁和钠属于活泼的金属,在水溶液中其离子不可能放电。1.6g若是铜,则转移的电子为![]() ,正确。若是银,则说明硝酸银不足,还有氢气生成,所以答案是BD。
,正确。若是银,则说明硝酸银不足,还有氢气生成,所以答案是BD。
(10分)下图是一个电化学过程的示意图。

请回答下列问题:
(1)图中甲池的名称 (填“原电池”“电解池”或“电镀池”)。
(2)写出通入CH3OH的电极的电极反应式: 。
(3)乙池中反应的化学方程式为 ,当乙池中B极的质量增加5.4g时,甲池中理论上消耗O2的体积为 L(标准状况下),此时丙池中 电极(填“C”或“D”)析出1.6g某金属,则丙池的某盐溶液可能是 (填序号)
A.MgSO4溶液 B.CuSO4溶液 C.NaCl溶液 D.AgNO3溶液
【解析】(1)甲属于燃料电池,给乙池和丙池供电。在燃料电池中可燃物在负极通入,所以电极反应式为CH3OH+8OH――6e-=CO32-+6H2O。电极A和电池的正极相连,所以A是阳极、B是阴极、C是阳极、D是阴极。A是惰性电极,所以乙池中反应式为4AgNO3+2H2O
 4Ag+O2↑+4HNO3。5.4g是单质银,转移的电子是
4Ag+O2↑+4HNO3。5.4g是单质银,转移的电子是 ,所以根据得失电子守恒可知氧气的物质的量是
,所以根据得失电子守恒可知氧气的物质的量是 。金属阳离子只有在阴极放电,所以在D电极放电。镁和钠属于活泼的金属,在水溶液中其离子不可能放电。1.6g若是铜,则转移的电子为
。金属阳离子只有在阴极放电,所以在D电极放电。镁和钠属于活泼的金属,在水溶液中其离子不可能放电。1.6g若是铜,则转移的电子为 ,正确。若是银,则说明硝酸银不足,还有氢气生成,所以答案是BD。
,正确。若是银,则说明硝酸银不足,还有氢气生成,所以答案是BD。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com