
题目列表(包括答案和解析)
化学在生产、生活中有着广泛的应用。下列做法正确的是
A.农作物收获后,就地焚烧秸秆,增加土壤中钾肥含量
B.回收制革工厂的边角皮料生产食用明胶,加工成医用胶囊或做食品增稠剂
C.将工业废水“再生”处理,用于城市道路保洁、喷泉和浇花用水
D.食品加工时,尽可能多的使用各种色素、香味剂等添加剂,改善食品的品质
化学在生产、生活中有着广泛的应用。下列做法正确的是
| A.农作物收获后,就地焚烧秸秆,增加土壤中钾肥含量 |
| B.回收制革工厂的边角皮料生产食用明胶,加工成医用胶囊或做食品增稠剂 |
| C.将工业废水“再生”处理,用于城市道路保洁、喷泉和浇花用水 |
| D.食品加工时,尽可能多的使用各种色素、香味剂等添加剂,改善食品的品质 |
甲醇是重要的化工原料,在日常生活中有着广泛的应用。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ:CO(g)+2H2(g)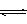 CH3OH(g)
CH3OH(g)
反应Ⅱ:CO2(g)+3H2(g)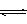 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①在以上制备甲醇的两个反应中:反应Ⅰ优于反应Ⅱ,原因为_________________。
②对于反应Ⅰ,下图甲表示能量的变化;图乙表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时闻峦化。
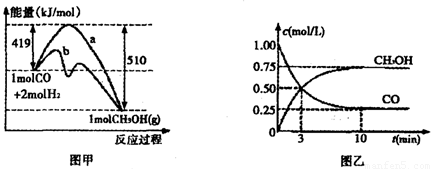
在“图甲”中,曲线__________(填:“a”或“b”)表示使用了催化剂;该反应属于________(填:“吸热”、“放热”)反应。在图乙中从反应开始到建立平衡,用H2浓度变化表示的反应速率为_____________;该温度下CO(g)+2H2(g)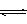 CH3OH(g)的化学平衡常数为__________.
CH3OH(g)的化学平衡常数为__________.
③对于反应Ⅱ,在一定温度时,将lmol CO2年和3mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为a,则容器内的平衡压强与起始压强之比为__________;若容器容积不变,下列措施可增加甲醇产率的是____________。
a.升高温度
b.增加CO2的量
c.充入He,使体系总压强增大
d.按原比例再充入CO2和H2
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种 污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程。
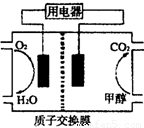
①阳极电极反应式为____________。
②除去甲醇的离子方程式为________________。
碱金属元素在科学研究和生产生活中有着广泛用途。
(1)锂是最轻的金属,如果用锂做一架飞机,两个人就可以抬动。锂在元素周期表中的表示如右图所示,填写以下空格。
①Li在元素周期表中的位置: 。
②6.941的意义: __________________________。
(2)光电管是利用碱金属铯受到光照射时能形成电流这一光电效应的性质制成的。
①完成铯的原子结构示意图:
②下列有关铯的说法正确的是________。
| A.其单质在常温下与水反应不如钠剧烈 |
| B.其原子半径比钾原子半径小 |
| C.其氢氧化物的水溶液不能使氢氧化铝溶解 |
| D.其碳酸盐易溶于水 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com