
题目列表(包括答案和解析)
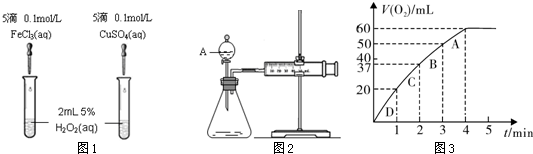
| ||
| ||
| 1 |
| 3 |
| 3 |
| 4 |
| ||
| ||
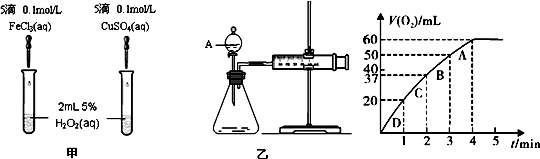
(1)若甲、乙两室中装入液体的体积相同,对于实验开始阶段的描述正确的是( )
A.水分子从甲室向乙室的扩散速度大于乙室向甲室的扩散速度
B.水分子从乙室向甲室的扩散速度大于甲室向乙室的扩散速度
C.两室中水分子的相互扩散速度相等
D.两室中水分子互不扩散
(2)对实验进行足够长时间后的情况预测,正确的是( )
A.最终两室中水分子的相互扩散速度可以相等
B.甲室中淀粉的浓度与原来相同
C.甲室中溶液体积比原来大,乙室中水的体积比原来小
D.甲、乙两室液体体积仍然相同
(3)相同条件下,甲室装入质量分数为1%的尿素[CO(NH2)2]水溶液,乙室装入等体积的质量分数为a%的葡萄糖溶液,若两溶液的密度均近似看成1g/cm3,若要使两室中水分子相互扩散速度相等,则a的近似值为( )
A.1 B.2 C.3 D.4
用一种只有水分子能自由通过,而直径较大的溶质分子不能通过的隔膜,把水槽隔离成大小完全相同的甲、乙两室,甲室中装入淀粉溶液,乙室中装入蒸馏水,此时甲、乙两室中的水分子均可自由地通过隔膜而相互扩散,已知这种扩散速度与单位体积内溶质的微粒数成反比,而与液体的压强成正比。根据以上叙述回答下面三个小题。
(1)若甲、乙两室中装入液体的体积相同,对于实验开始阶段的描述正确的是( )
A.水分子从甲室向乙室的扩散速度大于乙室向甲室的扩散速度
B.水分子从乙室向甲室的扩散速度大于甲室向乙室的扩散速度
C.两室中水分子的相互扩散速度相等
D.两室中水分子互不扩散
(2)对实验进行足够长时间后的情况预测,正确的是( )
A.最终两室中水分子的相互扩散速度可以相等
B.甲室中淀粉的浓度与原来相同
C.甲室中溶液体积比原来大,乙室中水的体积比原来小
D.甲、乙两室液体体积仍然相同
(3)相同条件下,甲室装入质量分数为1%的尿素[CO(NH2)2]水溶液,乙室装入等体积的质量分数为a%的葡萄糖溶液,若两溶液的密度均近似看成1g/cm3,若要使两室中水分子相互扩散速度相等,则a的近似值为( )
A.1 B.2 C.3 D.4

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com