
题目列表(包括答案和解析)
化学实验在化学学习中具有重要的作用。
(1)下列与实验有关的叙述正确的是????????? (填序号)。
①氨水、浓硝酸和溴化银都必须存放在配有磨口塞的棕色玻璃瓶中
②容量瓶、分液漏斗、酸(碱)式滴定管等仪器在使用前都必须检验是否漏水
③用稀盐酸即可鉴别Na2SiO3、NaHCO3、Na[Al(OH)4]、Na2SO4四种溶液
④乙酸与乙醇的混合液可用分液漏斗进行分离
⑤用托盘天平准确称取29.25gNaCl固体,配制500mL0.5mol·L-1 NaCl溶液
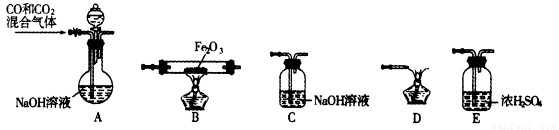
(2)实验室用Fe2O3与CO反应来制取单质Fe。
①请按气流方向连接下列所有装置(每种装置只允许使用一次),合理的顺序为A ?????? 。
?????? 。
②装置C的作用是??????????? 。
化学实验在化学学习中具有重要的作用。
(1)下列与实验有关的叙述正确的是 (填序号)。
①氨水、浓硝酸和溴化银都必须存放在配有磨口塞的棕色玻璃瓶中
②容量瓶、分液漏斗、酸(碱)式滴定管等仪器在使用前都必须检验是否漏水
③用稀盐酸即可鉴别Na2SiO3、NaHCO3、Na[Al(OH)4]、Na2SO4四种溶液
④乙酸与乙醇的混合液可用分液漏斗进行分离
⑤用托盘天平准确称取29.25gNaCl固体,配制500mL0.5mol·L-1 NaCl溶液
(2)实验室用Fe2O3与CO反应来制取单质Fe。
①请按气流方向连接下列所有装置(每种装置只允许使用一次),合理的顺序为A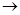 。
。
②装置C的作用是 。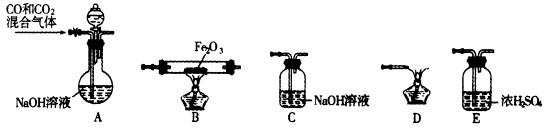
(20分)
(I)多项选择题(6分)
关于化工生产的下列叙述中,正确的是 。
A.生产普通玻璃的原料是石灰石、石英、纯碱,在玻璃熔炉中发生复杂的物理化学变化
B.工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的
C.加热法只适用于软化暂时硬度的硬水
D.工业上采用电解熔融氯化铝生产金属铝
E.用高纯度焦炭与石英砂反应可制得纯度达到9个9的单晶硅材料
(II)(14分)
工业上制取硝酸铵的流程图如下,请回答下列问题:?
(1)1909年化学家哈伯在实验室首次合成了氨。2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意如下:
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。
(2)在合成氨的设备(合成塔)中,设置热交换器的目的是 ;
在合成硝酸的吸收塔中通入空气的目的是 。
(3)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:
碱液吸收法:NO+NO2+2NaOH===2NaNO2+H2O
NH3还原法:8NH3+6NO2 7N2+12H2O(NO也有类似的反应)
请从绿色化学的角度分析两种方法的优劣:
(4)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的 %。
(5)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,把应注意的事项及理由填入下表。
|
| 注意事项 | 理由 |
| ① |
|
|
| ② |
|
|
(20分)
(I)多项选择题(6分)
关于化工生产的下列叙述中,正确的是 。
| A.生产普通玻璃的原料是石灰石、石英、纯碱,在玻璃熔炉中发生复杂的物理化学变化 |
| B.工业上合成氨没有采用更大的压强是从设备和动力要求方面考虑的 |
| C.加热法只适用于软化暂时硬度的硬水 |
| D.工业上采用电解熔融氯化铝生产金属铝 |
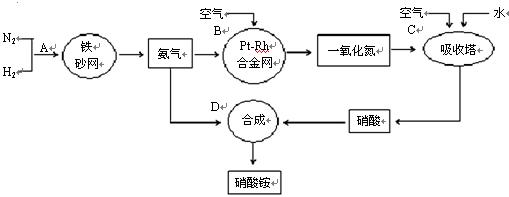
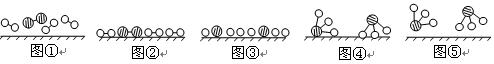
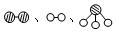 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是 、 。 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)| | 注意事项 | 理由 |
| ① | | |
| ② | | |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com