
题目列表(包括答案和解析)
下列物质作漂白剂时,是利用该物质还原性的是
A.SO2使品红褪色 B.H2C2O4使蓝墨水褪色
C.臭氧使有色布条褪色 D.H2O2使石蕊褪色
 海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.
海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.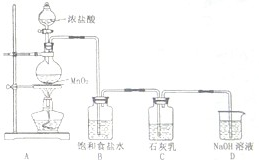
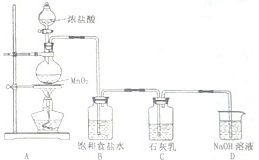 海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.
海水占地球总蓄水量的97.2%,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源.
| ||
| ||
| ||
| ||
我们生活中的许多现象及大量物质的应用都与氧化还原反应有关。请运用氧化还原反应的知识回答下列问题。
⑴ 氯气与水反应生成的次氯酸(HClO)具有杀菌作用,常用于自来水的消毒。在次氯酸(HClO)中,氯元素的化合价为 ,氯原子容易得到电子,从而使氯元素化合价降低,因此次氯酸具有 。次氯酸具有漂白作用就是基于它的这个性质。
⑵ 氮化铝(AlN)具有耐高温、抗冲击,导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3 + N2 + 3C = 2AlN + 3CO
① 在化学方程式上标出该反应中电子转移的方向和数目。
② 在该反应中,还原剂是(写化学式) ,氧化产物是(写化学式) 。
⑶ 一个体重 50 kg的健康人,体内约有2 g铁,这2 g铁在人体内不是以单质的形式存在,而是以Fe2+和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体的吸收。
① 在人体中进行Fe2+ ![]() Fe3+的转化时,a中的Fe2+作 剂,b中的Fe3+作 剂。
Fe3+的转化时,a中的Fe2+作 剂,b中的Fe3+作 剂。
② “服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中作 剂,具有 性。
③ 市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸(主要成分是盐酸)的作用下转化为亚铁盐,此反应的离子方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com