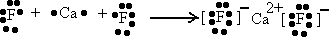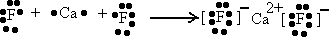有X、Y、Z三种元素,已知:
①X
2-、Y
-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY
3,ZY
3溶液遇苯酚呈紫色.
请回答:
(1)若X与Z元素形成ZX
2化合物,则ZX
2的电子式
,其中含有的化学键有
共价键 离子键
共价键 离子键
.
(2)将ZY
3溶液滴入沸水可得到红褐色液体,反应的离子方程式是
,此液体具有的性质是
abd
abd
(填写序号字母).
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼热后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体.
①已知一定条件下,每1mol该气体被O
2完全氧化放热98.0kJ,写出该反应的热化学方程式
2SO2(g)+O2(g)=2 SO3(g);△H=-196kJ/mol
2SO2(g)+O2(g)=2 SO3(g);△H=-196kJ/mol
.若2mol该气体与1molO
2在此条件下发生反应,达到平衡时放出的热量是176.4kJ,则该气体的转化率为
90%
90%
.
②原无色有刺激性气味的气体与含1.5mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×10
23个电子转移时,该反应的化学方程式是
SO2+2HClO3=H2SO4+2ClO2
SO2+2HClO3=H2SO4+2ClO2
.
(4)Y的最高价氧化物对应水化物的化学式是
HClO4
HClO4
.
①常温下,将20mL0.1mol?L
-1的该物质的水溶液与VmL0.1mol?L
-1的氨水混合后pH=7,则V
>
>
20mL(填“>”“<”或“=”)
②常温下,将pH=2的该物质的水溶液V
1mL与V
2mL0.01mol?L
-1的氨水混合后,溶液呈酸性,则V
1与V
2的关系满足
D
D
A.V
1>V
2 B.V
1<V
2 C.V
1=V
2 D.无法确定
此时溶液中带电微粒的浓度大小顺序可能为
c(ClO4-)>c(NH4+)>c(H+)>c(OH-)或c(ClO4-)>c(H+)>c(NH4+)>c(OH-) 或 c(ClO4-)>c(NH4+)=c(H+)>c(OH-)
c(ClO4-)>c(NH4+)>c(H+)>c(OH-)或c(ClO4-)>c(H+)>c(NH4+)>c(OH-) 或 c(ClO4-)>c(NH4+)=c(H+)>c(OH-)
.
(5)Z的高价硝酸盐溶液中滴加足量HI溶液的离子方程式:
Fe3++3NO3-+12H++10I-=Fe2++5I2+3NO↑+6H2O
Fe3++3NO3-+12H++10I-=Fe2++5I2+3NO↑+6H2O
.



 下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.
下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.