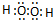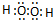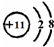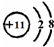A、B、C、D、E、F是原子序数依次增大的前四周期元素.A、B、C三种元素的基态原子具有相同的能级和能层,且第一电离能的顺序为A<C<B,其中C原子基态时2p轨道有两个未成对电子;D与A同族,其单质为常用的半导体材料;E为前四周期电负性最小的元素;F原子内层无空轨道,最外层电子数与E相同.请回答:
(1)F
+的价层电子排布为
;写出化合物F
2C与稀硫酸反应的产物之一为红色固体且反应中只有F元素化合价发生了变化,该反应的离子方程式
.
(2)B、D形成一种超硬、耐磨、耐高温的新型化合物,该化合物化学式为
,属于
晶体.
由氢气与C
2反应生成1mol气态H
2C产物,放热241.8KJ,若1g 气态H
2C转化成液态H
2C放热2.444KJ,则反应:2H
2(g)+C
2(g)=2H
2C(L)的△H=
KJ/mol.
(3)C与氢元素形成的正一价离子含有10电子,该离子中C原子的杂化方式为
; C与氢元素形成的一种18电子分子M的水溶液具有弱酸性,则M与Ba(OH)
2溶液反应生成酸式盐的化学方程式为
.
(4)1molAC
2分子中σ键与π键的数目之比为
;B、C形成的正一价离子N与AC
2互为等电子体,N的电子式为
;常温下,若1molAC
2与等物质的量的NaOH反应后的溶液pH等于9,则c( H
2CO
3)-c( CO
32-)=
.