
题目列表(包括答案和解析)
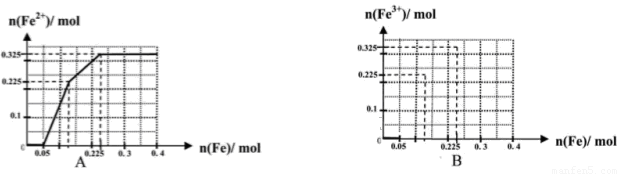
(一)(8分)在含有物质的量各为0.1 mol FeCl3、H2SO4、Cu(NO3)2的溶液500 mL中,逐渐加入铁粉,溶液中n(Fe2+)与加入n(Fe)的关系如图A(请注意识图,该题图中每小正方格长度为0.05mol)。(提示:忽略离子水解产生的影响;如果有硝酸根被还原时,则生成一氧化氮气体)
(1)写出图中n(Fe)从0.125mol-0.225 mol段对应反应的离子方程式____。
(2)写出图中n(Fe)从0-0.05 mol段对应反应的离子方程式____。
(3)请在图B中画出溶液中n(Fe3+)与加入n(Fe)的变化关系图
(4)当反应进行到最后,取该溶液2mL加入试管中,为了证明该溶液中有NO3-存在,可以向试管中在滴加_______。
A.酸性KMnO4溶液??? B.含有盐酸的KSCN溶液??? C.碘水??? D.次氯酸钠溶液
(二)(5分)下图是电解槽的剖面图,箭头的方向指的是气体或溶液的流向,阳离子交换膜只允许阳离子通过。现要用此装置来通过电解分离Na2SO4和NaOH的混合溶液,则向装置中通入A1溶液和A2溶液(A1溶液是Na2SO4和NaOH的混合溶液,A2溶液是NaOH的稀溶液)。电解一段时间后,装置中流出:B2溶液(是NaOH的浓溶液)和B1溶液,C1气体和C2气体。
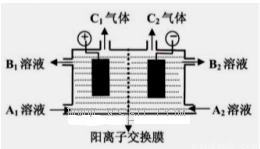
(1) C2气体是______(填化学式)。
(2)请写出阳极反应的电极方程式???????????????????????????????? .
(3)请简述阴极室能流出NaOH的浓溶液的原因????????????????????????? .
| 50w |
| 9av |
| 50w |
| 9av |
| a |
| b |
| 5 |
| 6 |
| a |
| b |
| 5 |
| 6 |
| 1.2a +b |
| 8.96 |
| 1.2a +b |
| 8.96 |
| 2.016 |
| 22.4 |
| 0.896 |
| 22.4 |
| 2.016 |
| 22.4 |
| 0.896 |
| 22.4 |
| NaOH起始读数 | NaOH终点读数 | 第一次 | 0.10mL | 18.40mL | 第二次 | 0.30mL | 18.40mL |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com