
题目列表(包括答案和解析)
加入物质 结果 变化量 | H2O | NH4Cl(s) | NaOH(s) | HCl(l) |
n(OH-) |
|
|
|
|
c(OH-) |
|
|
|
|
平衡移动方向 |
|
|
|
|
发射航天火箭常用氮的氢化物肼(N2H4)作燃料。试回答下列有关问题:
(1)写出N2的电子式
(2)液态NH3类似H2O,也能微弱电离且产生电子数相同的两种离子,则液态NH3电离方程式为_________________________________。
(3)25℃时,0.1 mol·L-1 NH4NO3溶液中水的电离程度________________ (填“大于”、“等于“或“小于”)0.1 mol·L-l NaOH溶液中水的电离程度。若将0.1mol·L-1NaOH和0.2mol·L-1 NH4NO3两溶液等体积混合,所得溶液中离子浓度由大到小的顺序为________________。
(4)在结构上N2H4和NH3的关系有如H2O2和H2O的关系。N2H4能发生下列反应:
N2H4+H3O+==N2H5++H2O N2H4+H2O![]() N2H5++OH-
N2H5++OH-
N2H5++H2O![]() N2H62++OH- N2H5++ H2O
N2H62++OH- N2H5++ H2O![]() N2H4+H3O+
N2H4+H3O+
据此可得出的结论是______________________。
A.肼水解显酸性 B.肼在水中电离出H+离子
C.肼是二元弱碱 D.肼是二元弱酸
(5)发射火箭时肼(N2H4)为燃料,双氧水作氧化剂,两者反应生成氮气和气态水。已知3.2gN2H4(l)在上述反应中放出64.22kJ的热量,写出该反应的热化学方程式
________ 。
因此肼可以作为火箭推进剂。根据该反应,你认为是否可以通过改变反应条件,由N2和水来制取N2H4,若能,指出可能的反应条件;若不能,请指出原因。
。

 Cu2++4NH3
Cu2++4NH3 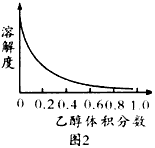

 Cu2++4NH3②(NH4)·SO4在水中可溶,在乙醇中难溶。
Cu2++4NH3②(NH4)·SO4在水中可溶,在乙醇中难溶。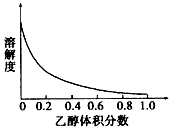
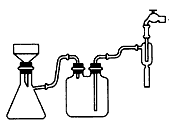
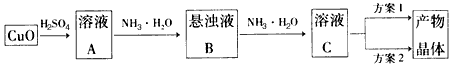
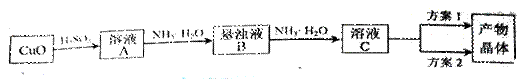
(15分)一水硫酸四氨合铜(Ⅱ)的化学式为[Cu(NH3)4]SO4·H2O是一种重要的染料及农药中间体。某学习小组在实验室以氧化铜为主要原料合成该物质,设计的合成路线为:
相关信息如下:
①[Cu(NH3)4]SO4·H2O在溶液中存在以下电离(解离)过程:
![]() [Cu(NH3)4]SO4·H2O=[Cu(NH3)4]2++
[Cu(NH3)4]SO4·H2O=[Cu(NH3)4]2++![]() +H2O
+H2O
[Cu(NH3)4]2+ Cu2++4NH3
②(NH4)2SO4在水中可溶,在乙醇中难溶。
③[Cu(NH3)4]SO4·H2O在乙醇·水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图如下:


请根据以下信息回答下列问题: 图3
(1)方案1的实验步骤为:
a. 加热蒸发 b. 冷却结晶 c. 抽滤 d. 洗涤 e. 干燥
①步骤1的抽滤装置如图3所示,该装置中的错误之处是 ;抽滤完毕或中途停止抽滤时,应先 ,然后 。
②该方案存在明显缺陷,因为得到的产物晶体中往往含有 杂质,产生该杂质的原因是 。
(2)方案2的实验步骤为:
a. 向溶液C中加入适量 ,b. ,c. 洗涤,d. 干燥
①请在上述内填写合适的试剂或操作名称。
②下列选项中,最适合作为步骤c的洗涤液是 。
A. 乙醇 B. 蒸馏水 C. 乙醇和水的混合液 D. 饱和硫酸钠溶液
③步骤d不宜采用加热干燥的方法,可能的原因是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com