
题目列表(包括答案和解析)
 Ⅰ:如图表示800℃时,A、B、C三种气体物质的浓度随时间的变化情况,t1是达到平衡状态的时间.试回答:
Ⅰ:如图表示800℃时,A、B、C三种气体物质的浓度随时间的变化情况,t1是达到平衡状态的时间.试回答:
| ||
| ||
 Ⅰ、写出甲烷燃料电池在酸性溶液中的电极反应和总电池反应:
Ⅰ、写出甲烷燃料电池在酸性溶液中的电极反应和总电池反应:| 周围变红的电极代号(填字母) | 原因 |
A A |
O2+2H2O+4e-=4OH-,产生OH- O2+2H2O+4e-=4OH-,产生OH- |
E E |
2H++2e-=H2↑ H+反应,促进了水的电离,溶液中c(OH-)>c(H+) 2H++2e-=H2↑ H+反应,促进了水的电离,溶液中c(OH-)>c(H+) |
无 无 |
无 无 |
无 无 |
无 无 |
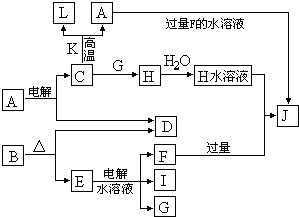
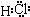
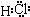
| ||
| ||
| ||
| ||
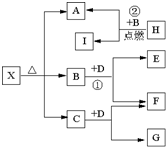 Ⅰ、有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的
Ⅰ、有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,A元素的原子是半径最小的原子.B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的| 3 |
| 4 |
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com