
题目列表(包括答案和解析)
(16分)碳及其化合物与人类生产、生活密切相关。请回答下列问题:
(1)在化工生产过程中,少量CO的存在会引起催化剂中毒。为了防止催化剂中毒,常用SO2将CO氧化SO2被还原为S。
已知: C(s)+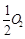 (g)=CO(g)ΔH1=-126.4kJ/mol ①
(g)=CO(g)ΔH1=-126.4kJ/mol ①
C(s)+O2(g)=CO2(g) ΔH2= -393.5kJ·mol-1 ②
S(s)+O2(g)=SO2(g) ΔH3= -296.8kJ·mol-1 ③
则SO2氧化CO的热化学反应方程式:
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。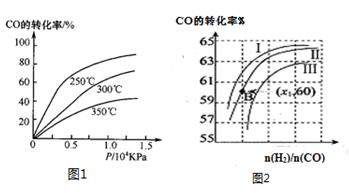
①CO在不同温度下的平衡转化率与压强的关系如图1所示,该反应ΔH 0(填“>”或“ <”)。
图2表示CO的转化率与起始投料比[ n(H2)/n(CO)]、温度的变化关系,曲线I、II、III对应的平衡常数分别为K1、K2、K3,则K1、K2、K3的大小关系为 ;测得B(X1,60)点氢气的转化率为40%,则x1= 。
②在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是 (填序号)。
| A.正反应速率先增大后减小 | B.逆反应速率先增大后减小 |
| C.化学平衡常数K值增大 | D.反应物的体积百分含量增大 |
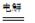 CH3CHOH+CH3CHOOH。
CH3CHOH+CH3CHOOH。
下图中A、B、C、D、E均为有机化合物。已知:C能跟NaHCO3(发生反应,C和D的相对分子质量相等,且E为无支链的化合物。
根据上图回答问题:
(l) C分子中的官能团名称是_______;化合物B不_发生的反应是_______(填字母序号):
a、加成反应b、取代反应C、消去反应d、酯化反应e、水解反应f、置换反应
(2) 反应②的化学方程式是______________。
(3) 试分析反应②加热的原因。
I、___________________________________。
II 、___________________________________
(4) A的结构简式是_____________________。
(5) 同时符合下列三个条件的B的同分异构体的数目有_______个。
I.间二取代苯环结构;II.属于非芳香酸酯;III-与FeCl3溶液发生显色反应。
写出其中任意一个同分异构体的结构简式_____________________。
(6) 常温下,将C溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
从m组情况分析,所得混合溶液中由水电离出的c(OH )=_______mol.L-1.
n组混合溶液中离子浓度由大到小的顺序是______________。
下图中A、B、C、D、E均为有机化合物。已知:C能跟NaHCO3(发生反应,C和D的相对分子质量相等,且E为无支链的化合物。
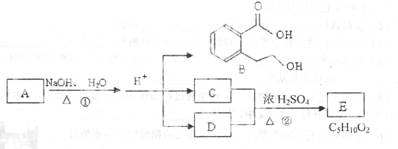
根据上图回答问题:
(l) C分子中的官能团名称是_______;化合物B不_发生的反应是_______(填字母序号):
a、加成反应b、取代反应C、消去反应d、酯化反应e、水解反应f、置换反应
(2) 反应②的化学方程式是______________。
(3) 试分析反应②加热的原因。
I、___________________________________。
II 、___________________________________
(4) A的结构简式是_____________________。
(5) 同时符合下列三个条件的B的同分异构体的数目有_______个。
I.间二取代苯环结构;II.属于非芳香酸酯;III-与FeCl3溶液发生显色反应。
写出其中任意一个同分异构体的结构简式_____________________。
(6) 常温下,将C溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:

从m组情况分析,所得混合溶液中由水电离出的c(OH )=_______mol.L-1.
n组混合溶液中离子浓度由大到小的顺序是______________。
(14分)I.科学家一直致力于“人工固氮”的新方法研究。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2 (g)+6H2O (l)4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| 温度 T/K | 303 | 313 | 323 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
① 此合成反应的a 0 (填“>”“<”或“=”)
② 已知:
N2 (g) + 3H2(g)2NH3 (g) ΔH=-92.4 kJ·mol-1,
2H2 (g)+ O2 (g)===2H2O (l) ΔH=-571.6 kJ·mol-1,
则2N2 (g) + 6H2O (l)4NH3 (g) + 3O2 (g) ΔH= ;
(2)用水稀释0.1 mol·L-1氨水,溶液中随着水量的增加而减小的是 (填字母标号)
II.工业生产中产生含SO2的废气,经石灰吸收和氧化后制成硫酸钙,硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、水泥等。
(1)硫酸生产中,SO2催化氧化成SO3的热化学方程式为:
2SO2 (g) + O2(g)2SO3 (g) ΔH=-196.0 kJ·mol-1
① 容器体积不变时,为了提高SO2的转化率,可采用的措施是 (填字母标号)
A.加入V2O5作催化剂 B.使用过量SO2 C.高温 D.通入过量空气
② 某温度时,在一个容积为10L的密闭容器中充入4.0 molSO2和2.0 molO2,半分钟后达到平衡,并放出352.8kJ的热量。此时SO2的转化率是 ,该温度下的平衡常数K= ;
(2)已知25℃时,Ksp(CaSO4)=7.10×10-5。向0.100 L 含CaSO4固体的溶液中加入2.22 gCaCl2 粉末充分搅拌,假设溶液的体积变化忽略不计,则溶液中CaSO4固体的质量将 (填“增大”、“减小”或“不变”,下同),Ksp(CaSO4)将 。
(14分)I.科学家一直致力于“人工固氮”的新方法研究。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2 (g)+6H2O (l) 4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1
4NH3 (g)+3O2 (g) ΔH= a kJ·mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
|
温度 T/K |
303 |
313 |
323 |
|
NH3生成量/(10-6 mol) |
4.8 |
5.9 |
6.0 |
① 此合成反应的a 0 (填“>”“<”或“=”)
② 已知:
N2 (g) + 3H2(g) 2NH3 (g) ΔH=-92.4 kJ·mol-1,
2NH3 (g) ΔH=-92.4 kJ·mol-1,
2H2 (g) + O2 (g)===2H2O (l) ΔH=-571.6 kJ·mol-1,
则2N2 (g) + 6H2O (l) 4NH3 (g) + 3O2 (g) ΔH=
;
4NH3 (g) + 3O2 (g) ΔH=
;
(2)用水稀释0.1 mol·L-1氨水,溶液中随着水量的增加而减小的是 (填字母标号)

II.工业生产中产生含SO2的废气,经石灰吸收和氧化后制成硫酸钙,硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、水泥等。
(1)硫酸生产中,SO2催化氧化成SO3的热化学方程式为:
2SO2 (g) + O2(g) 2SO3 (g) ΔH=-196.0 kJ·mol-1
2SO3 (g) ΔH=-196.0 kJ·mol-1
① 容器体积不变时,为了提高SO2的转化率,可采用的措施是 (填字母标号)
A.加入V2O5作催化剂 B.使用过量SO2 C.高温 D.通入过量空气
② 某温度时,在一个容积为10L的密闭容器中充入4.0 molSO2和2.0 molO2,半分钟后达到平衡,并放出352.8kJ的热量。此时SO2的转化率是 ,该温度下的平衡常数K= ;
(2)已知25℃时,Ksp(CaSO4)=7.10×10-5。向0.100 L 含CaSO4固体的溶液中加入2.22 gCaCl2 粉末充分搅拌,假设溶液的体积变化忽略不计,则溶液中CaSO4固体的质量将 (填“增大”、“减小”或“不变”,下同),Ksp(CaSO4)将 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com