Ⅰ.纯碱的产量是衡量一个国家化学工业发展水平的重要指标.下面是实验室摸拟侯氏制碱法生产原理的主要过程:
①20℃时,向浓氨水中通入足量的二氧化碳得到NH
4HCO
3饱和溶液;
②向NH
4HCO
3饱和溶液中加入食盐细粒,并不断搅拌,直到NaHCO
3结晶析出完毕;
③将析出的晶体过滤,得到晶体和滤液,洗涤晶体,然后将晶体充分加热,得到Na
2CO
3;
④向③的滤液中加入食盐细粒,析出NH
4Cl晶体,过滤,得到NH
4Cl.
(1)请写出步骤②和③的化学方程式.
②:
;
③:
.
(2)侯氏制碱法的优点之一是所得的副产品氯化铵是一种氮肥.该化合物遇碱会生成有刺激性气味的气体
(写化学式,下同),此气体可使紫色石蕊试液变蓝,以上反应现象可用于检验氯化铵中的阳离子.若要通过实验区分氯化铵和另一种氮肥硝酸铵,常用的试剂是
溶液,请比较这两种氮肥中氮元素的质量分数:氯化铵
硝酸铵(选填“>”、“<”或“=”).
Ⅱ.侯氏制碱法所得的纯碱中常含有少量氯化钠,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等固定用装置已略去).
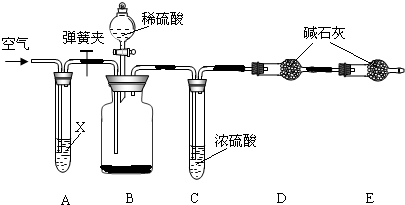
实验步骤如下:
①按图连接装置,并检查气密性;
②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为83.4g;
③准确称得6.0g纯碱样品放入装置B的广口瓶中;
④打开装置B的分液漏斗旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;
⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为85.6g.
试回答:
(1)鼓入空气的目的是
,装置A中试剂X最适宜选用
.
(2)若没有C装置,则会导致测定结果
(填“偏大”或“偏小”).
(3)E装置的作用是
.
(4)请根据实验中测得的有关数据,计算纯碱样品中碳酸钠的质量分数.(要求:写出计算过程,结果保留一位小数)


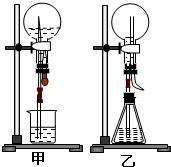 15、喷泉是一种常见的自然现象,其产生原因是存在压强差.
15、喷泉是一种常见的自然现象,其产生原因是存在压强差.