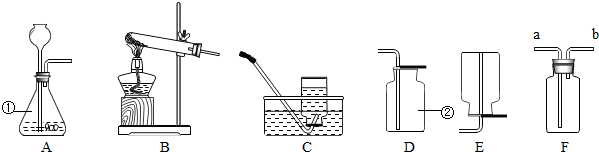
实验室制取气体所需的装置如图所示,请回答下列问题:
(1)写出装置图中标号仪器的名称:a
集气瓶
集气瓶
.
(2)实验室制取二氧化碳的化学方程式为
CaCO3+2HCl═CaCl2+H2O+CO2↑
CaCO3+2HCl═CaCl2+H2O+CO2↑
,所选用的发生、收集组合装置为
AD
AD
(填字母).
(3)实验室用装置A制取氧气,若用C装置收集氧气,当观察到导管口有气泡
连续、均匀
连续、均匀
地放出时,即可进行收集.
(4)选择气体收集方法时,气体的下列性质:①颜色②密度③溶解性④可燃性,其中必须考虑的是
②③
②③
(填序号).
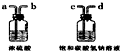
(5)为得到纯净干燥的二氧化碳气体,除杂装置(如图)的导管按气流方向连接顺序是(选填字母).
A.a→b→c→d B.b→a→c→d C.c→d→a→b D.d→c→b→a
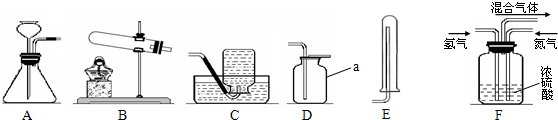
(6)氨气是一种无色、有刺激性气味、极易溶于水的气体,可用于制氮肥、硝酸、药物和染料等.
①实验室常用加热氯化铵和熟石灰的固体混合物的方法制取氨气,则实验室制取并收集氨气应选择的装置组合是
BE
BE
.发生的方程式是
2NH
4Cl+Ca(OH)
2CaCl
2+2H
2O+2NH
3↑
2NH
4Cl+Ca(OH)
2CaCl
2+2H
2O+2NH
3↑
,氨气和空气中氧气达到爆炸极限V%):16%~25%,遇
明火
明火
或者静电发生爆炸.氨中毒:在人体组织内遇水生成氨水,可以溶解组织蛋白质,所以尾气最好用
D
D
吸收.
A清水 B用导管插入浓盐酸 C用导管插入稀硫酸中 D用倒立漏斗插入稀硫酸中
②工业上用氮气和氢气合成氨气:N
2+3H
22NH
3.实验室模拟合成氨气的流程如下:
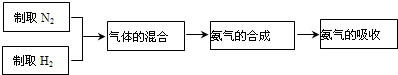
流程中“气体的混合”是在F装置中进行的,F装置的作用有三个:一是将氮气和氢气干燥;二是使氮气和氢气充分混合;三是
使氢气和氮气气流稳定
使氢气和氮气气流稳定
,从而提高氮气和氢气的利用率.

 如图是电解水的简易装置.回答下列各问题:
如图是电解水的简易装置.回答下列各问题: 如图是电解水的简易装置:
如图是电解水的简易装置: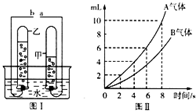 如图是电解水的简易装置,图Ⅱ为电解水生成的气体体积与时间关系图,试完成下列问题:
如图是电解水的简易装置,图Ⅱ为电解水生成的气体体积与时间关系图,试完成下列问题: