硫元素的单质和化合物应用广泛.
(1)硫代硫酸钠(Na
2S
2O
3)是常用的还原剂.在维生素C(化学式C
6H
8O
6)的水溶液中加入过量I
2溶液,使维生素C完全氧化,剩余的I
2用Na
2S
2O
3溶液滴定,可测定溶液中维生素C的含量.发生的反应为:
C
6H
8O
6+I
2═C
6H
6O
6+2H
++2I
- 2S
2O
32-+I
2═S
4O
62-+2I
-在一定体积的某维生素C溶液中加入a mol?L
-1I
2溶液V
1mL,充分反应后,用Na
2S
2O
3溶液滴定剩余的I
2,消耗b mol?L
-1Na
2S
2O
3溶液V
2mL.
①指示剂用
.
②滴定终点判断方法
.
③该溶液中维生素C的物质的量是
mol.
(2)在酸性溶液中,碘酸钾(KIO
3)被亚硫酸钠还原成I
2,完成下列方程式:
IO
3-+
SO
32-+
=
I
2+
+
生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率.某同学设计实验如下表所示:
|
0.01mol?L-1
KIO3酸性溶液(含淀粉)的体积/mL |
0.01mol?L-1
Na2SO3溶液的体积/mL |
H2O的体积
/mL |
实验温度
/℃ |
溶液出现蓝色时所需时间/s |
| 实验1 |
5 |
V1 |
35 |
25 |
t1 |
| 实验2 |
5 |
5 |
40 |
25 |
t2 |
| 实验3 |
5 |
5 |
V2 |
0 |
t3 |
该实验的目的是
,表中V
2=
mL.
(3)某化学兴趣小组为探究SO
2的性质,按如图所示装置进行实验.
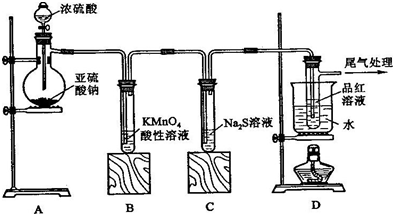
请回答下列问题:
①装置A中盛放亚硫酸钠的仪器名称是
.
②实验过程中,装置B、C中分别说明SO
2具有的性质是
.
③装置D的目的是探究SO
2与品红作用的可逆性,请写出实验操作、现象及结论
.

