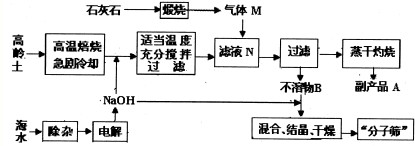
【化学--选修2:化学与技术】“材料”的发现和使用往往会极大地推动生产、生活的发展,一些材料的出现甚至具有里程碑式划时代的意义.请回答下列问题:
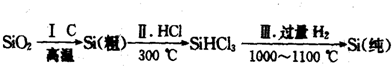
(1)无机非金属材料.高纯度单晶硅是典型的无机非金属材料,又称“半导体”材料,它的发现和使用曾引起计算机的一场“革命”.这种材料可以按下列方法制备:
①写出步骤I的化学方程式:
.
②步骤II经过冷凝得到的SiHCl
3(沸点为33.0℃)中含有少量的SiCl
4(沸点为57.6℃)和HCl(沸点为-84.7℃),提纯SiHCl
3的实验方法是
.
(2)磁性材料.这种材料一般含有铁元素,铁是用途最为广泛的金属,也较为活泼,所以从它的使用开始就不断实施着对它的使用开始就不断实施着对它的防护.最常见的铁制品腐蚀就是电化学腐蚀,请写出最为普遍的电化学腐蚀的负极反应式:
.
(3)激光材料.我国是激光技术先进的国家,红宝石(Al
2O
3)是最早用于产生激光的材料,它是一种两性氧化物,请用离子方程式加以说明:
_、
.
(4)高分子材料.它可以分成无机高分子材料和有机高分子材料.一种新型高效净水剂[AlFe(OH)
nCl
6-n]
m就属于无机高分子材料,它广泛应用生活用水和工业污水的处理,其中铁元素的化合价为
;一种合成纤维腈纶,又称“人造羊毛”,由丙烯腈(CH
2=CH-CN)为原料聚合生成,请写出生成该有机高分子材料的化学方程式:
.
(5)合金材料.14g铜银合金与一定量某浓度的硝酸完全反应后,将放出的气体与1.12L(标准状况下)O
2混合通入水中,恰好全部被水吸收,则合金中铜的质量为
g.

 新型陶瓷氮化铝可用Al2O3高温还原法制备:Al2O3+3C+N
新型陶瓷氮化铝可用Al2O3高温还原法制备:Al2O3+3C+N 铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.
铝、铁、铜的单质、合金及其化合物在生产生活中的应用日趋广泛.