
题目列表(包括答案和解析)
| O | 2- 7 |
| 氢氧化物开始沉淀时的pH | 氢氧化物开始沉淀完全时的pH | |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cr3+ | 6.0 | 8.0 |
| O | 2- 7 |
| O | 2- 7 |
| O | 2- 7 |
| O | 2- 7 |
| O | 2- 7 |
| O | 2- 7 |
(16分)环境中常见的重金属污染有:汞、铅、锰、铬、镉。处理工业废水中常含有的Cr2O2-7和CrO2-4离子,常用的方法有两种。
方法1:还原沉淀法
该法的工艺流程为: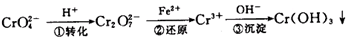
其中第①步存在平衡:
(1)写出第①步反应的平衡常数表达式 。
(2)关于第①步反应,下列说法正确的是 。
A.通过测定溶液的pH值可以判断反应是否已达平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 molCr2O2-7离子,需要 mol的FeSO4·7H2O。
(4)第③步除生成的Cr(OH)3,还可能生成的沉淀为 。在溶液中存在以下沉淀溶解平衡: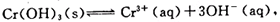 常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
方法2:电解法
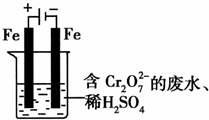
(5)实验室利用如图装置模拟电解法处理含Cr2O2-7的废水,电解时阳极反应式为 ,阴极区反应式为 ,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是 。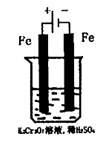
(16分)环境中常见的重金属污染有:汞、铅、锰、铬、镉。处理工业废水中常含有的Cr2O2-7和CrO2-4离子,常用的方法有两种。
方法1:还原沉淀法
该法的工艺流程为:
其中第①步存在平衡:
(1)写出第①步反应的平衡常数表达式 。
(2)关于第①步反应,下列说法正确的是 。
A.通过测定溶液的pH值可以判断反应是否已达平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 molCr2O2-7离子,需要 mol的FeSO4·7H2O。
(4)第③步除生成的Cr(OH)3,还可能生成的沉淀为 。在溶液中存在以下沉淀溶解平衡:常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH值调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程)
方法2:电解法
(5)实验室利用如图装置模拟电解法处理含Cr2O2-7的废水,电解时阳极反应式为 ,阴极区反应式为 ,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是 。
(11分)欲降低废水中重金属元素铬的毒性,可将Cr2O2-7转化为Cr(OH)3沉淀除去。已知:

(1)某含铬废水处理的主要流程如图所示:
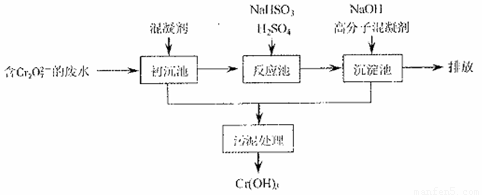
①沉池中加入的混凝剂是K2SO4·Al2(SO4)3·24H2O,用离子方程式表示其反应原理
。
②反应池中发生主要反应的离子方程式是Cr2O2—7+3HSO—3+5H+===2Cr3++3SO2—4+H2O。根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是 、 。证明Cr3+沉淀完全的方法是 。
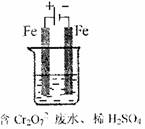
(2)工业亦可用电解法来处理含Cr2O2-7废水。实验室利用如图模拟处理含Cr2O2-7的废水,阳极反应式是Fe—2e—===Fe2+,阴极反应式是2H++2e—=H2↑。Fe2+与酸性溶液中的Cr2O2—7反应生成Cr3+和Fe3+,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是: 。
用电解法处理该溶液中0.01molCr2O2-7时,至少得到沉淀的质量是 g。
(11分)欲降低废水中重金属元素铬的毒性,可将Cr2O2-7转化为Cr(OH)3沉淀除去。已知:
(1)某含铬废水处理的主要流程如图所示:
①沉池中加入的混凝剂是K2SO4·Al2(SO4)3·24H2O,用离子方程式表示其反应原理
。
②反应池中发生主要反应的离子方程式是Cr2O2—7+3HSO—3+5H+===2Cr3++3SO2—4+H2O。根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是 、 。证明Cr3+沉淀完全的方法是 。
(2)工业亦可用电解法来处理含Cr2O2-7废水。实验室利用如图模拟处理含Cr2O2-7的废水,阳极反应式是Fe—2e—===Fe2+,阴极反应式是2H++2e—=H2↑。Fe2+与酸性溶液中的Cr2O2—7反应生成Cr3+和Fe3+,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是: 。
用电解法处理该溶液中0.01molCr2O2-7时,至少得到沉淀的质量是 g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com