
题目列表(包括答案和解析)
(1)只有氧化性的是____________。(填数码代号,下同)
(2)只有还原性的是____________。
(3)既有氧化性又有还原性的是____________。
某研究性学习小组在网上收集到如下信息:![]() 溶液可以蚀刻银,制作美丽的银饰。
溶液可以蚀刻银,制作美丽的银饰。
他们对蚀刻银的原因进行了如下探究:
【实验】 制备银镜,并与![]() 溶液反应,发现银镜溶解。
溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是 。
a.边振荡盛有2%的![]() 溶液的试管,边滴入2%的氨水。至最初的沉淀恰好溶解为止
溶液的试管,边滴入2%的氨水。至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2 mL乙醛中 c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性 e.在银氨溶液配制过程中,溶液的pH增大
【提出假设】
假设1:![]() 具有氧化性,能氧化Ag。 假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag。
具有氧化性,能氧化Ag。 假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO3-能氧化Ag。
【设计实验方案,验证假设】
(2)甲同学从上述实验的生成物中检验出![]() 验证了假设1成立。请写出
验证了假设1成立。请写出![]() 氧化Ag的离子方程式___________
氧化Ag的离子方程式___________
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示:![]() 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
实验步骤 (不要求写具体操作过程) | 预期现象和结论 |
① ② …… | 若银镜消失,假设2成立。 若银镜不消失,假设2不成立。 |
【思考与交流】
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立。则丙同学由此得出结论:![]() 溶液中的
溶液中的![]() 和
和![]() 都氧化了Ag。你是否同意丙同学的结论,并简述理由: 。
都氧化了Ag。你是否同意丙同学的结论,并简述理由: 。
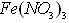 溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:
溶液可以蚀刻银,制作美丽的银饰。他们对蚀刻银的原因进行了如下探究:  溶液反应,发现银镜溶解。
溶液反应,发现银镜溶解。  溶液的试管,边滴入2%的氨水。至最初的沉淀恰好溶解为止
溶液的试管,边滴入2%的氨水。至最初的沉淀恰好溶解为止 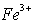 具有氧化性,能氧化Ag。 假设2:
具有氧化性,能氧化Ag。 假设2: 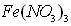 溶液显酸性,在此酸性条件下
溶液显酸性,在此酸性条件下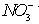 能氧化Ag 。
能氧化Ag 。 验证了假设1成立。请写出
验证了假设1成立。请写出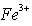 氧化Ag的离子方程式________________________。
氧化Ag的离子方程式________________________。 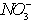 在不同条件下的还原产物较复杂,有时难以观察到气体 产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体 产生)。 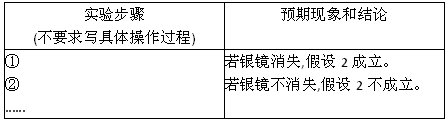
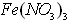 溶液中的Fe2+和NO3-都氧化了Ag。你是否同意丙同学的结论,并简述理由
溶液中的Fe2+和NO3-都氧化了Ag。你是否同意丙同学的结论,并简述理由(1)氧化性:__________________________________________________________________。
(2)还原性:__________________________________________________________________。
溴和海水提溴
1.溴的存在
地球上99%的溴元素以Br-的形式存在于海水中.溴被称为________.溴是海水中的常量元素.
2.卤族元素
F、Cl、Br、I等原子结构和元素性质有一定的相似性,通称为卤族元素.
3.溴单质和碘单质的物理性质
实验1:

实验2:碘受热不经液体直接变成了固体——升华.
由于液态溴容易挥发成溴蒸气,因此,常常在盛溴的试剂瓶里加一些水来防止溴挥发,贮于阴凉处密闭保存.
由于碘易升华,所以必须将碘置于阴凉处,密闭保存.
碘易升华的性质,常用于碘的制取和从混合物中的分离,提取指纹等.
4.氯、溴、碘单质氧化性的强弱
实验方案和实验记录:
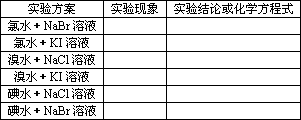
归纳整理1:氧化性:Cl2>Br2>I2(>S)
归纳整理2:Cl2可从溴化物的溶液里把Br2置换出来:
2Br-+Cl2![]() Br2+2Cl-
Br2+2Cl-
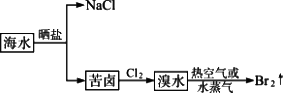
5.海水提溴的工艺流程
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com