
题目列表(包括答案和解析)
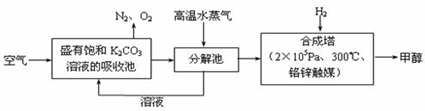
最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。“绿色自由”构想技术流程如下:

(1)分解池中发生分解反应的物质是 。
(2)在合成塔中,若有2.2kgCO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式 。
(3)①从平衡移动原理分析,低温有利于原料气的转化,而实际生产中采用300°C的温度,原因之一是考虑到催化剂的催化活性,原因之二是 。
②从合成塔中分离出甲醇的原理与下列哪个相符 (选填字母)。
a.过滤 b.分液 c.蒸馏
③“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括 。
(4)右图是甲醇燃料电池的结构示意图。已知电池总反应为:
2CH3OH+3O2=2C![]() O2+4H2O。通入a—端的电极是 (填“正极”或“负极”),负极发生的电极反应是 。
O2+4H2O。通入a—端的电极是 (填“正极”或“负极”),负极发生的电极反应是 。

(14分)最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
(1)在合成塔中,若有2.2kgCO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式 。
(2)①上述合成反应具有一定的可逆性,从平衡移动原理分析,低温有利于原料气的转化,而实际生产中采用300°C的温度,其原因是 。
②“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括 。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(3)甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式 。当电子转移的物质的量为 时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)常温下,0.1 mol/L KHCO3溶液的pH大于8,则溶液中各种离子浓度由大到小的顺序为:
。
(14分)最近科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使空气中的CO2转变为可再生燃料甲醇。“绿色自由”构想技术流程如下:

(1)在合成塔中,若有2.2kgCO2与足量H2恰好完全反应,生成气态的水和甲醇,可放出2473.5kJ的热量,试写出合成塔中发生反应的热化学方程式 。
(2)①上述合成反应具有一定的可逆性,从平衡移动原理分析,低温有利于原料气的转化,而实际生产中采用300°C的温度,其原因是 。
②“绿色自由”构想技术流程中常包括物质和能量的“循环利用”,上述流程中能体现“循环利用”的除碳酸钾溶液外,还包括 。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(3)甲醇可制作燃料电池。写出以氢氧化钾为电解质的甲醇燃料电池负极反应式 。当电子转移的物质的量为 时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)常温下,0.1 mol/L KHCO3溶液的pH大于8,则溶液中各种离子浓度由大到小的顺序为:
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com