[化学--物质结构与性质]
四种常见元素:A、B、C、D为周期表前四周期元素,原子序数依次递增,它们的性质或结构信息如下表.试根据信息回答有关问题.
| 元素 |
A |
B |
C |
D |
结构性质
信息 |
基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子数相同 |
原子核外有两个电子层,最外层有3个未成对的电子 |
基态原子的M层有2对成对的p电子 |
其原子序数比A、B、C三种元素原子的质子数总和还少1,有+1、+2两种常见化合价 |
(1)写出D原子的外围电子排布式______,A、B、C、D四种元素的第一电离能最小的是______(用元素符号表示).
(2)B元素的氢化物的沸点比同主族相邻元素氢化物沸点______(填“高”或“低”).
(3)元素F与A相邻且同主族,它们与氧元素的成键情况如下:
|
A-O |
A=O |
F-O |
F=O |
| 键能(KJ/mol) |
360 |
803 |
464 |
640 |
在A和O之间通过双键形成AO
2分子,而F和O则不能和A那样形成有限分子,原因是______.
(4)往D元素的硫酸盐溶液中逐滴加入过量B元素的氢化物水溶液,可生成的配合物,该配合物中不含有的化学键是______(填序号).a.离子键 b.极性键c.非极性键d.配位键 e.金属键
(5)下列分子结构图中的“

”表示上述相关元素的原子中除去最外层电子的剩余部分,“

”表示氢原子,小黑点“

”表示没有形成共价键的最外层电子,短线表示共价键.
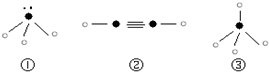
则在以上分子中,中心原子采用sp
3杂化形成化学键的是______(填序号);在②的分子中有______个σ键和______个π键.
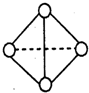
(6)已知一种分子B
4分子结构如图所示,断裂1molB-B吸收aKJ的热量,生成1molB≡B放出bKJ热量.试计算反应:B
4(g)═2B
2(g)△H=______KJ/mol.

 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“ ”表示没有形成共价键的最外层电子,短线表示共价键.
”表示没有形成共价键的最外层电子,短线表示共价键.


 化学对人类社会进步和发展的贡献之一是发现和研制了各种材料,无机非金属材料和金属材料在我们生活中有着极其广泛的用途.根据你学过的有关材料的知识,回答下列问题:
化学对人类社会进步和发展的贡献之一是发现和研制了各种材料,无机非金属材料和金属材料在我们生活中有着极其广泛的用途.根据你学过的有关材料的知识,回答下列问题:



