NH
3在催化剂存在时能还原NO
x为N
2和H
2O,这是目前国外硝酸厂进行尾气治理所普遍采用的一种方法.下图是某校化学兴趣小组设计的模拟氨气还原NO的装置.
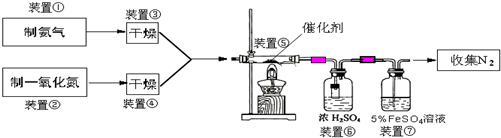
回答下列问题:
(1)若制取氨气用A装置,则发生反应的化学方程式为
2NH
4Cl+Ca(OH)
2CaCl
2+2NH
3↑+2H
2O
2NH
4Cl+Ca(OH)
2CaCl
2+2NH
3↑+2H
2O
.若用B装置制取氨气,则分液漏斗和锥形瓶中盛放的药品分别是
浓氨水、碱石灰
浓氨水、碱石灰
.

(2)若制取NO用图C装置,则制取NO的离子方程式为
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
,用可抽动的铜丝其优点是
反应可以随时关停、操作方便、反复使用、节约药品
反应可以随时关停、操作方便、反复使用、节约药品
.
(3)装置⑦的作用可能是
吸收未反应的NO
吸收未反应的NO
.
(4)活性亚铬酸铜(可写成xCuO?yCr
2O
3的形式,x、y为正整数)是氨气还原NO催化剂.已知CuNH
4(OH)CrO
4在295℃分解生成活性亚铬酸铜催化剂、一种无毒气体及水,写出该反应的化学方程式
2Cu(OH)NH
4CrO
4Cr
2O
3?2CuO+N
2↑+5H
2O
2Cu(OH)NH
4CrO
4Cr
2O
3?2CuO+N
2↑+5H
2O
.
(5)若进入装置⑤的NO共2688mL(已折算为标准状况,下同),氨气过量,最后收集到标准状况下2016mL N
2,则NO的转化率为
90%
90%
.


