高铁酸钾(K
2FeO
4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂.工业上常采用NaClO氧化法生产,其生产工艺如下:

主要反应为:3NaClO+2Fe(NO
3)
3+10NaOH=2Na
2FeO
4↓+3NaCl+6NaNO
3+5H
2O Na
2FeO
4+2KOH=K
2FeO
4+2NaOH.
(1)写出反应①的离子方程式:
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.
(2)从“混合物II”中分离出K
2FeO
4后,会有副产品
NaNO3、NaCl、NaOH
NaNO3、NaCl、NaOH
(写化学式),它们都是重要的化工产品,具体说出其中一种物质的用途
NaNO3作炸药,NaCl用作调味品或氯碱工业原料等
NaNO3作炸药,NaCl用作调味品或氯碱工业原料等
.
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响.图Ⅰ为不同的温度下,Fe(NO
3)
3不同质量浓度对K
2FeO
4生成率的影响;图Ⅱ为一定温度下,Fe(NO
3)
3质量浓度最佳时,NaClO浓度对K
2FeO
4生成率的影响.
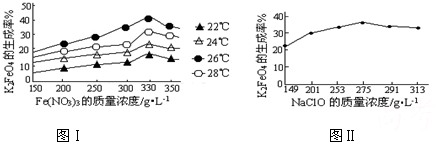
根据图分析:工业生产中最佳温度为
26
26
℃,此时Fe(NO
3)
3与NaClO两种溶液最佳质量浓度之比为
1.2
1.2
.
(4)K
2FeO
4 在水溶液中易水解:4FeO
42-+10H
2O

4Fe(OH)
3+8OH
-+3O
2↑.在提纯K
2FeO
4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
B
B
溶液(填序号).
A.H
2O B.CH
3COONa、异丙醇 C.NH
4Cl、异丙醇 D.Fe(NO
3)
3、异丙醇
(5)将适量K
2FeO
4溶解于pH=4.74的溶液中,配制成c(FeO
42-)=1.0mmol?L
-1的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO
42-)的变化,结果见图Ⅲ.该实验的目的是
探究温度对FeO42-浓度的影响(或其他合理答案)
探究温度对FeO42-浓度的影响(或其他合理答案)
.

(6)FeO
42-在水溶液中的存在形态如图Ⅳ所示.下列说法正确的是
C
C
(填字母).
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.向pH=10的这种溶液中加硫酸至pH=2,HFeO
4-的分布分数逐渐增大
C.向pH=6的这种溶液中加KOH溶液,发生反应的离子方程式为:HFeO
4-+OH
-=FeO
42-+H
2O.







 +RCl
+RCl (-R为羟基)
(-R为羟基)
 (-R为羟基)
(-R为羟基)



 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:

 4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用







 表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应和遇氯化铁溶液发生显色反应的2种物质的结构简式
表示(其中X、Y均不为H),试写出符合上述通式且能发生银镜反应和遇氯化铁溶液发生显色反应的2种物质的结构简式 (或其它合理答案)
(或其它合理答案) (或其它合理答案)
(或其它合理答案)