
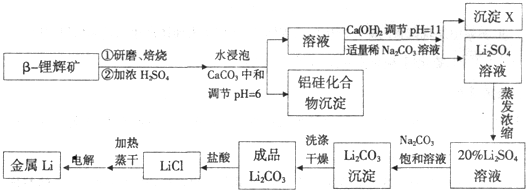
题目列表(包括答案和解析)
(10分)钛被认为是21世纪的重要金属材料。纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
Ⅰ.目前大规模生产钛的方法是:第一步 首先将金红石(TiO2)、炭粉混合,在高温条件下通入氯气制得TiCl4;第二步 在氮气氛围中用过量的镁在加热条件下与TiCl4反应制得金属钛。
已知:① C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1 ② 2CO(g)+O2(g)=2CO2(g)
△H=-566kJ·mol-1 ③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) △H=+141kJ·mol-1
则:TiO2(g)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的△H= 。
Ⅱ.纳米TiO2可通过TiCl4水解制备,过程为:在冰水浴强力搅拌下,将一定量的TiCl4滴加到溶有HCl和(NH4)2SO4的冰的TiCl4水溶液中,控制TiCl4浓度为1.1mol/L时撤去冰浴,逐步升温到95℃,恒温水解1h后,滴加氨水,调节溶液pH约为6,自然冷却后过滤,产物经水洗至无Cl-和SO42-后,再用乙醇洗涤3遍,高温煅烧2h制备纳米TiO2。⑴TiCl4水解生成TiO2·x H2O的化学方程式为_____________________。
⑵简述升温和调节溶液pH的目的: 。
Ⅲ.在制造TiO2过程中,需要测定Ti(Ⅳ)的含量。测定时首先将TiO2溶解为钛液,然后取10mL用水冲稀10倍,加过量铝粉,充分振荡,使其完全反应:
Ti(Ⅳ)+Al→Ti3++Al3+。过滤后,取出滤液20mL,向其中滴加2~3滴KSCN溶液,再加5 mL蒸馏水振荡,用酸式滴定管滴加0.1mol/L FeCl3溶液,终点到来时,用去了30mL的FeCl3溶液。⑴滴定终点的现象是____________________________________。[来
⑵原钛液的物质的量浓度为 。
⑶若在滴定终点读取滴定管刻度时,俯视标准液液面,则使Ti(Ⅳ)的含量测定结果_________(填“偏高”、“偏低”或“无影响”)。
(1)上述反应的实验现象为____________________________________________________,因此铝可用于制造信号弹、燃烧弹、火箭推进剂等。
(2)上述反应的化学方程式为:________________________________________________,此反应称为铝热反应,铝粉和氧化铁粉末的混合物称为铝热剂,铝热反应可用于焊接铁轨。铝粉可以和铁、铬、锰的氧化物粉末发生铝热反应,铝变成氧化铝,铁、铬、锰等金属的氧化物变成相应的金属单质。写出下面反应的方程式。
Al+MnO2_________________________________________________________;
Al+Fe2O3_________________________________________________________;
Al+Cr2O3_________________________________________________________。
将两张圆形滤纸分别折叠成漏斗状,套在一起使四周都是四层,把内层“纸漏斗”取出,在底部剪一个孔,用水湿润,再与另一“纸漏斗”套在一起,架在铁架台铁圈上,下面放有盛有细沙的蒸发皿,将5 g炒干的三氧化二铁粉末和2 g铝粉混合均匀,放在“纸漏斗”中,上面加少量氯酸钾,并在混合物中插一根镁条,用燃着的木条点燃镁条.完成下列问题:
(1)上述反应的实验现象为________,因此铝可用于制造信号弹、燃烧弹、火箭推进剂等.
(2)上述反应的化学方程式为:________,此反应称为铝热反应,铝粉和氧化铁粉末的混合物称为铝热剂,铝热反应可用于焊接铁轨.铝粉可以和铁、铬、锰的氧化物粉末发生铝热反应,铝变成氧化铝,铁、铬、锰等金属的氧化物变成相应的金属单质.写出下面反应的方程式.
Al+MnO2________;
Al+Fe2O3________;
Al+Cr2O3________.
[探究实验一]:某同学探究同周期主族元素性质递变规律时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系):
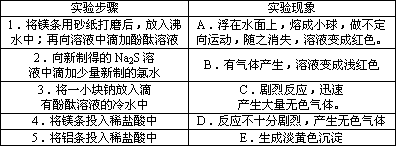
请你帮助该同学整理并完成实验报告.
(1)实验目的:探究同周期主族元素性质递变规律.
(2)实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na2S溶液.仪器:①________,②________,③________,试管夹,镊子,小刀,玻璃片,砂纸,酒精灯等.
(3)实验内容:(填写与实验步骤对应的实验现象的编号和离子方程式)

(4)若用最高价氧化物的水化物的碱性相对强弱来验证Mg、Al失电子能力的
强弱,请你设计实验(实验用品自选,不要求写化学方程式):________;
(5)实验结论:________;
[探究实验二]:一定条件下,氯化镁与四氯化钛的混合物可作烯烃聚合反应的催化剂.为了探究温度、氯化镁固体的含水量以及粉碎方式对该催化剂催化效果的影响,设计如下对比实验:
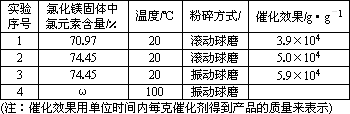
(6)表中ω=________;
(7)从实验1、2可以得出的结论是:________;
(8)设计实验2、3的目的是:________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com