
题目列表(包括答案和解析)
 4NO(g)+6H2O(g) △H=-905 kJ·mol-1
4NO(g)+6H2O(g) △H=-905 kJ·mol-1  2N2(g)+6H2O(g) △H=-1268 kJ·mol-1
2N2(g)+6H2O(g) △H=-1268 kJ·mol-1 | 元素 | Al | B | Be | C | Cl | F | Li |
| X | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | Fe |
| X | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 | 1.8 |
| 元素 | Al | B | Be | C | Cl | F | Li |
| X | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | Fe |
| X | 1.2 | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 | 1.8 |
含氯消毒剂和过氧化物等强氧化性消毒剂可防甲型H1N1流感。
 (1)过碳酸钠是一种有多种用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,
(1)过碳酸钠是一种有多种用途的新型氧系固态漂白剂,化学式可表示为Na2CO3·3H2O2,
它具有Na2CO3和H2O2的双重性质。
①H2O2有时可作为矿业废液消毒剂,如消除采矿业废液中的氰化物(如NaCN),经以下反应实现:NaCN+H2O2+H2O===A+NH3↑,则生成物A的化学式为_______________,
②某强酸性反应体系中,反应物和生成物共六种物质:O2、MnO![]() 、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→ O2。写出该反应的离子方程式:_________。
、H2O、Mn2+、H2O2、H+。已知该反应中H2O2只发生了如下过程:H2O2→ O2。写出该反应的离子方程式:_________。
(2)某天然碱的化学式可表示为:aNa2CO3·bNaHCO3·2H2O,取m g天然碱溶于水配成溶液,再向溶液中逐滴加入1 mol/L的盐酸,标准状况下
产生的CO2的体积与所加盐酸体积之间的关系某同学作出了如右图所示的A和B曲线,试回答下列问题:
①_______曲线正确,天然碱的化学式为___________,
③加盐酸后产生CO2气体体积(标准状况)的最大值为
_________________mL。
(3)漂白剂亚氯酸钠(NaClO2)在常温与黑暗处可保存一年。
亚氯酸不稳定可分解,反应的离子方程式为:HClO2—→ClO2↑+H++Cl-+H2O(未配平)。在该反应中,当有1 mol ClO2生成时转移的电子个数是________。
[化学—选修物质结构与性质](15分)
美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破。石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型及分子结构示意图如右: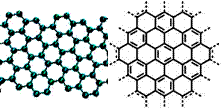
(1)下列有关石墨烯说法正确的是____。
| A.石墨烯的结构与金刚石相似 |
| B.石墨烯分子中所有原子可以处于同一平面 |
| C.12g石墨烯含σ键数为NA |
| D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com