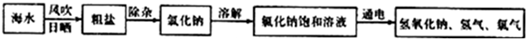在通常状况下,氯气是一种黄绿色气体,密度比空气大,易溶于水.在工业上、实验室中可以制作氯气,用来研究氯气的性质,并将其广泛用于实际生产和生活中.
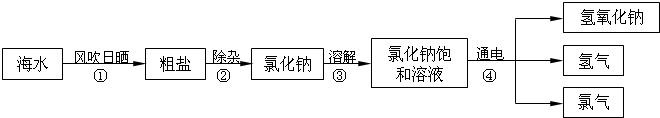
(1)在工业上,制取氯气的主要工艺流程如下:

①利用风吹日晒可以从海水中提取粗盐,该过程主要发生
物理
物理
(“物理”或“化学”)变化.
②要除去食盐水中混有的少量泥沙,可选择的操作方法是
过滤
过滤
.
③氯化钠溶液在通电条件下发生反应的化学方程式为
.
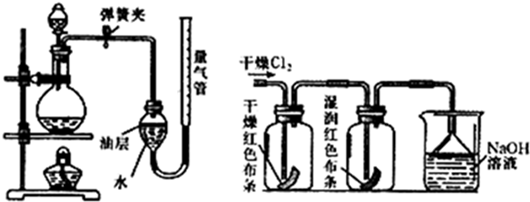
(2)在实验室中,可以用加热二氧化锰和浓盐酸来制取氯气,可采用如图装置制取氯气并测量产生Cl
2的体积.
①能采用该气体发生装置的理由是
二氧化锰和浓盐酸制取氯气,需要加热
二氧化锰和浓盐酸制取氯气,需要加热
.
②该装置中油层的作用是
防止氯气与水反应
防止氯气与水反应
.
(3)氯气在常温下能分别与水、碱类等物质发生反应,并可以产生具有杀菌消毒、漂白(是有色物质褪色)等作用的物质.
①氯气与氢氧化钠溶液反应的化学方程式为Cl
2+2NaOH=NaCl+NaClO+H
2O.氯气与石灰乳反应可制漂白粉,有关化学方程式为
2Cl2 +2Ca(OH)2═CaCl2 +Ca(ClO)2 +2H2O
2Cl2 +2Ca(OH)2═CaCl2 +Ca(ClO)2 +2H2O
.
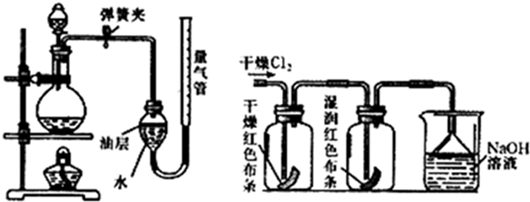
②氯气和水反应的原理是:Cl
2+H
2O=HCl+HclO.为了证明把氧气通入水的过程中,起漂白作用的物质是次氯酸(化学式为HClO),小明同学进行了如图所示的探究实验.你认为小明设计的方案能够达到目的吗?若能,请说明理由.若不能,请补充实验帮助小明达到实验目的(写出实验步骤、现象及结论).
(4)请计算:吸收14.2g氯气,需要消耗20%的氢氧化钠溶液多少克?