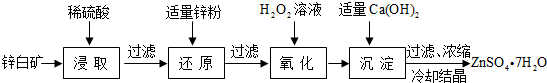
为节省药品和时间,甲、乙、丙三位同学用铜片、锌片、稀硫酸、CuSO
4溶液、直流电源、石墨电极、导线、烧杯、试管等中学化学常见的药品和仪器(用品),通过巧妙的构思,设计了比较铜、锌金属活动性相对强弱的系列实验.试填写下列空白:
(1)甲同学分别将一小片铜片、锌片置于烧杯底部(铜与锌不接触),向烧杯中小心加入稀硫酸,观察到的现象是
锌片上有气泡产生,铜片上无气泡
锌片上有气泡产生,铜片上无气泡
.甲同学的设计思路是
锌能置换出酸中的氢,而铜不能
锌能置换出酸中的氢,而铜不能
.
(2)乙同学接着甲的实验,向烧杯中滴加
硫酸铜
硫酸铜
溶液,进而观察到的现象是
锌片上有红色的铜析出,锌片上产生气泡的速率明显加快
锌片上有红色的铜析出,锌片上产生气泡的速率明显加快
.
乙同学作出锌、铜金属活动性相对强弱的结论所依据的原理是
活泼金属可以把不活泼金属从其盐溶液中置换出来(或Zn、Cu、稀硫酸组成原电池,Zn为负极)
活泼金属可以把不活泼金属从其盐溶液中置换出来(或Zn、Cu、稀硫酸组成原电池,Zn为负极)
.
(3)丙同学使用直流电源、石墨电极组装好电解装置,向乙同学实验后的溶液中补充了必要的试剂
硫酸铜
硫酸铜
溶液(作为电解液).反应在调控下随即开始,实验中有关反应的化学方程式为
2CuSO
4+2H
2O
2Cu+O
2↑+2H
2SO
42CuSO
4+2H
2O
2Cu+O
2↑+2H
2SO
4.实验中的明显现象是
阴极上有红色铜析出,阳极附近有气体产生
阴极上有红色铜析出,阳极附近有气体产生
.
(4)请你再单独设计一个简单的实验(试剂、仪器自选),探究和证实锌、铜金属活动性的相对强弱(简要说明操作和现象)
分别取一小片铜片与锌片置于两支试管中,向试管中加入少量浅绿色的FeCl2溶液,片刻后,加锌片的试管中溶液的颜色褪去,溶液近乎无色(其他可行答案也可)
分别取一小片铜片与锌片置于两支试管中,向试管中加入少量浅绿色的FeCl2溶液,片刻后,加锌片的试管中溶液的颜色褪去,溶液近乎无色(其他可行答案也可)
.