
题目列表(包括答案和解析)
(8分)室温下,向一定量1mol/L氨水中逐滴加入物质的量浓度相同的盐酸,直至盐酸过量。请分析上述实验过程,回答下列问题:
(1)实验过程中水的电离程度变化趋势是先 后__ _(填“变大”.“变小”或“不变”)。
(2)实验过程中,当溶液pH恰好等于7时,此时溶液中主要溶质的化学式是__ _ _._ __,溶液中离子浓度的大小顺序是_________ ___ ______ 。
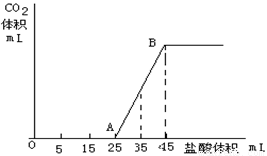
(一) 将2.5g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:

(1)写出OA段所发生反应的离子方程式
(2)当加入35mL盐酸时,产生二氧化碳的体积为 mL(标准状况)
(3)原混合物中Na2CO3的质量分数为???? 。
(二).氨是重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国化学家哈伯在1905年发明的,其合成原理为:N2(g) + 3H2(g)![]() 2NH3(g);
2NH3(g);
△H=―92.4 kJ/mol,他因此获得了1918年度诺贝尔化学奖。试回答下列问题:
⑴ 下列方法不适合实验室制取氨气的是 (填序号)。
A.向生石灰中滴入浓氨水 B.加热浓氨水
C.直接用氢气和氮气合成 D.向饱和氯化铵溶液中滴入浓氢氧化钠溶液
⑵ 合成氨工业中采取的下列措施可用勒夏特列原理解释的是 (填序号)。
A.采用较高压强(20 M Pa~50 M Pa)
B.采用500℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,未反应的N2和H2循环到合成塔中
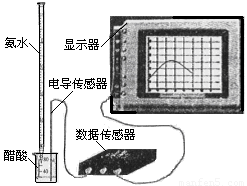
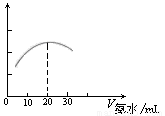
(3) 用数字化信息系统DIS(如下图Ⅰ所示:它由传感器、数据采集器和计算机组成)可以测定上述氨水的浓度。用酸式滴定管准确量取0.5000 mol/L醋酸溶液25.00 mL于烧杯中,以该种氨水进行滴定,计算机屏幕上显示出溶液导电能力随氨水体积变化的曲线如下图Ⅱ所示。


图Ⅰ 图Ⅱ
① 用滴定管盛氨水前,滴定管要用 润洗2~3遍,
② 试计算该种氨水的浓度: 。
③ 下列情况下,会导致实验结果c(NH3·H2O)偏低的是 。
A.滴定结束时仰视读数
B.量取25.00 mL醋酸溶液时,未用所盛溶液润洗滴定管
C.滴定时,因不慎将氨水滴在烧杯外
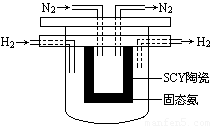
(4) 1998年希腊亚里士多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨。其实验装置如下图。

正极的电极反应式为: 。
(一)(6分) 将2.5g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
(1)写出OA段所发生反应的离子方程式
(2)当加入35mL盐酸时,产生二氧化碳的体积为 mL(标准状况)
(3)原混合物中Na2CO3的质量分数为 。
(二).氨是重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国化学家哈伯在1905年发明的,其合成原理为:N2(g) + 3H2(g)![]() 2NH3(g);
2NH3(g);
△H=―92.4 kJ/mol,他因此获得了1918年度诺贝尔化学奖。试回答下列问题:
⑴ 下列方法不适合实验室制取氨气的是 (填序号)。
A.向生石灰中滴入浓氨水 B.加热浓氨水
C.直接用氢气和氮气合成 D.向饱和氯化铵溶液中滴入浓氢氧化钠溶液
⑵ 合成氨工业中采取的下列措施可用勒夏特列原理解释的是 (填序号)。
A.采用较高压强(20 M Pa~50 M Pa)
B.采用500℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,未反应的N2和H2循环到合成塔中
(3) 用数字化信息系统DIS(如下图Ⅰ所示:它由传感器、数据采集器和计算机组成)可以测定上述氨水的浓度。用酸式滴定管准确量取0.5000 mol/L醋酸溶液25.00 mL于烧杯中,以该种氨水进行滴定,计算机屏幕上显示出溶液导电能力随氨水体积变化的曲线如下图Ⅱ所示。


图Ⅰ 图Ⅱ
① 用滴定管盛氨水前,滴定管要用 润洗2~3遍,
② 试计算该种氨水的浓度: 。
③ 下列情况下,会导致实验结果c(NH3·H2O)偏低的是 。
A.滴定结束时仰视读数
B.量取25.00 mL醋酸溶液时,未用所盛溶液润洗滴定管
C.滴定时,因不慎将氨水滴在烧杯外
(4) 1998年希腊亚里士多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨。其实验装置如下图。

正极的电极反应式为: 。
(一)(6分) 将2.5g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
(1)写出OA段所发生反应的离子方程式
(2)当加入35mL盐酸时,产生二氧化碳的体积为 mL(标准状况)
(3)原混合物中Na2CO3的质量分数为 。
(二).氨是重要的氮肥,是产量最大的化工产品之一。课本里介绍的合成氨技术叫哈伯法,是德国化学家哈伯在1905年发明的,其合成原理为:N2(g) + 3H2(g) 2NH3(g);
2NH3(g);
△H=―92.4 kJ/mol,他因此获得了1918年度诺贝尔化学奖。试回答下列问题:
⑴ 下列方法不适合实验室制取氨气的是 (填序号)。
A.向生石灰中滴入浓氨水 B.加热浓氨水
C.直接用氢气和氮气合成 D.向饱和氯化铵溶液中滴入浓氢氧化钠溶液
⑵ 合成氨工业中采取的下列措施可用勒夏特列原理解释的是 (填序号)。
A.采用较高压强(20 M Pa~50 M Pa)
B.采用500℃的高温
C.用铁触媒作催化剂
D.将生成的氨液化并及时从体系中分离出来,未反应的N2和H2循环到合成塔中
(3) 用数字化信息系统DIS(如下图Ⅰ所示:它由传感器、数据采集器和计算机组成)可以测定上述氨水的浓度。用酸式滴定管准确量取0.5000 mol/L醋酸溶液25.00 mL于烧杯中,以该种氨水进行滴定,计算机屏幕上显示出溶液导电能力随氨水体积变化的曲线如下图Ⅱ所示。
图Ⅰ 图Ⅱ
① 用滴定管盛氨水前,滴定管要用 润洗2~3遍,
② 试计算该种氨水的浓度: 。
③ 下列情况下,会导致实验结果c(NH3·H2O)偏低的是 。
A.滴定结束时仰视读数
B.量取25.00 mL醋酸溶液时,未用所盛溶液润洗滴定管
C.滴定时,因不慎将氨水滴在烧杯外
(4) 1998年希腊亚里士多德大学的Marnellos和Stoukides采用高质子导电性的SCY陶瓷(能传递H+),实现了高温常压下高转化率的电化学合成氨。其实验装置如下图。
正极的电极反应式为: 。
(16分)
(1)下列有关实验操作或结果的说法中错误的是
A.实验室在配制FeCl3溶液时,先将FeCl3溶于一定量的浓盐酸中,再加蒸馏水稀释至所需浓度
B.用广泛pH试纸测量Na2S溶液的pH时,得pH=10.5
C.滴定管洗净后经蒸馏水润洗后,即可注入标准液进行中和滴定实验
D.电解盐酸溶液后(盐酸过量),再通入一定量HCl气体时,电解质溶液可恢复到和原来一样
(2)氢氧化铝的酸式电离方程式:
(3)向明矾溶液中逐滴加入氢氧化钡溶液至铝离子刚好沉淀完全时,离子反应总方程式为:
(4)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号) 。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(5)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失), 和 两种粒子的物质的量之和比OH―多0.05mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com