
题目列表(包括答案和解析)
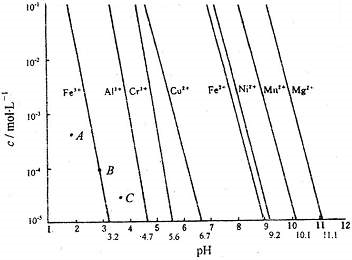
| 难溶电解质 | AgCl | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| Ksp | 1.8×10-10 | 8.3×10-17 | 5.6×10-18 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |

| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | -- | -- | -- |
| 沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺如下: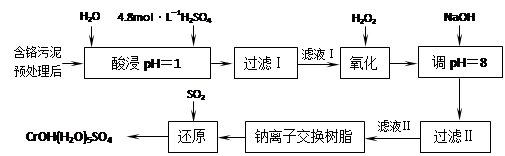
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L―1的浓硫酸配制250 mL 4.8 mol·L―1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和胶头滴管外,还需 。
(2)酸浸时,为了提高浸取率可采取的措施有 、
。(写出两个措施)
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72―,写出此反应的离子方程式:
。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | —— | —— | —— |
| 沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺如下:
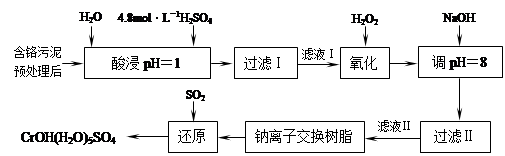
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L―1的浓硫酸配制250 mL 4.8 mol·L―1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和胶头滴管外,还需 。
(2)酸浸时,为了提高浸取率可采取的措施有 、
。(写出两个措施)
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72―,写出此反应的离子方程式:
。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | —— | —— | —— |
| 沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72―转化为CrO42―。滤液Ⅱ中阳离子主要有 ;但溶液的pH不能超过8,其理由是 。
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是 。
(6)写出上述流程中用SO2进行还原的化学方程式 。
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺如下:
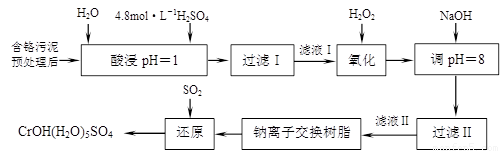
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用18.4 mol·L―1的浓硫酸配制250 mL 4.8 mol·L―1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和胶头滴管外,还需 。
(2)酸浸时,为了提高浸取率可采取的措施有 、
。(写出两个措施)
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72―,写出此反应的离子方程式:
。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
|
阳离子 |
Fe3+ |
Mg2+ |
Al3+ |
Cr3+ |
|
开始沉淀时的pH |
2.7 |
—— |
—— |
—— |
|
沉淀完全时的pH |
3.7 |
11.1 |
8 |
9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72―转化为CrO42―。滤液Ⅱ中阳离子主要有 ;但溶液的pH不能超过8,其理由是 。
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是 。
(6)写出上述流程中用SO2进行还原的化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com