
题目列表(包括答案和解析)
| 11.82g |
| 197g/mol |
| 11.82g |
| 197g/mol |
(8分)某研究小组探究SO2和Fe(NO3)3溶液的反应。
已知: 1.0 mol/L的Fe(NO3)3溶液中c(H+)=0.01mol/L
请回答:
(1)装置A中反应的化学方程式是 。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是 。
(3)装置B中产生了白色沉淀,其成分是 ,说明SO2具有 性。
(4)分析B中产生上述白色沉淀的原因可能是:
观点1: ;
观点2:SO2与Fe3+反应;
观点3:在酸性条件下SO2与NO3-反应;
①如果观点2正确,装置B中反应的离子方程式是
②如果想验证观点3,只需将装置B中的 Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是(填序号) 。
a.0.1 mol/L 稀硝酸
b.1.5 mol/L Fe(NO3)2溶液
c.6.0 mol/L NaNO3和0.02 mol/L盐酸等体积混合的溶液
【解析】(1)装置A是原来制取SO2的,所以方程式为Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O。
(2)可以通过通入氮气来排尽装置中的空气。
(3)硝酸铁溶液显酸性,因此生成的沉淀只能是硫酸钡沉淀,这说明SO2被硝酸铁氧化生成了硫酸,从而产生硫酸钡白色沉淀,因此SO2具有还原性。
(4)因为铁离子和硝酸跟离子均能氧化SO2,所以SO2被氧化生成硫酸,既可能是被铁离子氧化,也可能是被酸性条件下的硝酸跟离子氧化,后者是同时被氧化。要想验证观点③,就必须排除铁离子和硝酸的干扰, a是硝酸能直接氧化SO2,由于SO2溶于水显酸性,因此硝酸亚铁在酸性溶液中,亚铁离子可被硝酸氧化生成铁离子。因此答案选择c。
(8分)某研究小组探究SO2和Fe(NO3)3溶液的反应。

已知: 1.0 mol/L的Fe(NO3)3溶液中c(H+)=0.01mol/L
请回答:
(1)装置A中反应的化学方程式是 。
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是 。
(3)装置B中产生了白色沉淀,其成分是 ,说明SO2具有 性。
(4)分析B中产生上述白色沉淀的原因可能是:
观点1: ;
观点2:SO2与Fe3+反应;
观点3:在酸性条件下SO2与NO3-反应;
①如果观点2正确,装置B中反应的离子方程式是
②如果想验证观点3,只需将装置B中的 Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是(填序号) 。
a.0.1 mol/L 稀硝酸
b.1.5 mol/L Fe(NO3)2溶液
c.6.0 mol/L NaNO3和0.02 mol/L盐酸等体积混合的溶液
【解析】(1)装置A是原来制取SO2的,所以方程式为Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O。
(2)可以通过通入氮气来排尽装置中的空气。
(3)硝酸铁溶液显酸性,因此生成的沉淀只能是硫酸钡沉淀,这说明SO2被硝酸铁氧化生成了硫酸,从而产生硫酸钡白色沉淀,因此SO2具有还原性。
(4)因为铁离子和硝酸跟离子均能氧化SO2,所以SO2被氧化生成硫酸,既可能是被铁离子氧化,也可能是被酸性条件下的硝酸跟离子氧化,后者是同时被氧化。要想验证观点③,就必须排除铁离子和硝酸的干扰, a是硝酸能直接氧化SO2,由于SO2溶于水显酸性,因此硝酸亚铁在酸性溶液中,亚铁离子可被硝酸氧化生成铁离子。因此答案选择c。
(12分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);ΔH
CH3OH(g);ΔH
(1)已知,该反应在300℃,5MPa条件下能自发进行,则ΔH 0,△S 0 (填“<,>或=”)。
(2)在300℃,5MPa条件下,将0.20mol的 CO与0.58mol H2的混合气体充入2L密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示。

①在0~2min内,以H2表示的平均反应速率为 mol·L-1·s-1 。
②列式计算300℃时该反应的平衡常数K = 。
③300℃时,将0.50mol CO、1.00mol H2和1.00 mol CH3OH充入容积为2L的密闭容器中,此时反应将 。
A.向正方向移动 B.向逆方向移动 C.处于平衡状态 D.无法判断
④下列措施可增加甲醇产率的是
A.压缩容器体积 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入0.20mol CO和0.58mol H2
(3)若其它条件不变,使反应在500℃下进行,在图中作出甲醇的物质的量浓度随时间的变化的示意图。
【解析】(1)根据反应的特点可知△S小于0,因为反应在300℃,5MPa条件下能自发进行,所以根据△G=△H-T·△S可知反应是放热反应。
(2)①反应速率通常用单位时间内浓度的变化量来表示,根据图像可知反应进行到2min时甲醇
的浓度不再发生变化,平衡时甲醇的物质的量是0.04mol,则消耗氢气是0.08mol,所以在0~2min
内,以H2表示的平均反应速率为 。
。
②平衡时氢气的浓度是 ,CO的平衡浓度是
,CO的平衡浓度是
 ,所以该温度下的平衡常数为
,所以该温度下的平衡常数为 。
。
③300℃时,将0.50mol CO、1.00mol H2和1.00 mol
CH3OH充入容积为2L的密闭容器中,此时它们的浓度分别为0.25mol/L、0.50mol/L、、0.50mol/L,因为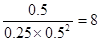 >4,所以反应向逆反应方向移动。
>4,所以反应向逆反应方向移动。
④压缩体积,压强增大,平衡向正反应方向移动。选项B是降低生成物浓度,平衡也向正反应方
向移动。充入He,使体系总压强增大,但物质但浓度没有变化,所以平衡不移动。再充入0.20mol
CO和0.58mol H2,相当于增大体系的压强,平衡向正反应方向移动,所以答案是ABD。
(3)因为反应是放热反应,所以升高温度平衡向逆反应方向移动,但反应速率会加快,所以图
像为

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com