
题目列表(包括答案和解析)
 A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物.回答下列问题:已知A、B、C、D、E、F六种短周期元素的性质或结构信息如下表,请根据信息回答下列问题。
元素 性质或结构信息
A 单质常温下为固体,难溶于水易于溶CS2。能形成2种二元含氧酸。
B 原子的M层有1个未成对的p电子。核外p电子总数大于7。
C 单质曾被称为“银色的金子”。与锂形成的合金常用于航天飞行器。单质能溶强酸和强碱。
D 原子核外电子层上s电子总数比p电子总数少2个。单质和氧化物均为空间网状晶体,具有很高的熔、沸点。
E 其氧化物是汽车尾气的主要有害成分之一,也是空气质量预报的指标之一;该元素在三聚氰胺中含量较高。
F 周期表中电负性最大的元素
(1)A原子的最外层电子排布式 ,D原子共有 种不同运动状态的电子。
(2)F与E元素第一电离能的大小关系: > (填元素符号)。
(3)A,B两元素的氢化物分子中键能较小的是 ;分子较稳定的是 。(填分子式)
(4)C单质、镁、NaOH溶液可以构成原电池,则负极的电极反应式为_________________。
(5)F与钙可组成离子化合物,其晶胞结构如图所示,该化合物的电子式是 。已知该化合物晶胞1/8的体积为2.0×10-23cm3,求该离子化合物的密度,请列式并计算(结果保留一位小数):_______________________。


2012年冬季,我国城市空气污染状况受到人们的强烈关注,其中NOx、CO、SO2是主要污染性气体。
I.汽车内燃机工作时发生的反应 是导致汽车尾 气中含有NO的重要原因之一。
是导致汽车尾 气中含有NO的重要原因之一。
(1)有人欲选用合适的催化剂,使反应2NO(g)=N2(g)+O2(g)能较快进行以达到除去NO的目的。你认为该反应能否自发进行 (填“能”或“不能”)。
(2)利用催化技术可将汽车尾气中的NO气体转化成无毒气体,相关反应的平衡常数可表示为
 ,此反应为放热反应。在一定温度下,10L某密闭容器中发生上述反应,各物质的物质的量的变化情况如下表
,此反应为放热反应。在一定温度下,10L某密闭容器中发生上述反应,各物质的物质的量的变化情况如下表

①根据土表数据计算0~4s间用NO表示的平均速率v(NO)= ;达到化学平衡时两种反应物的转化率是否相等 (填“相等”或“不相等”)。
②在5~6s时,若K增大,5s后正反应速率 (填“增大”或“减小”)
③在5~6s时,若K不变,以上各物质的物质的量变化原因可能是 。
A.选用更有效的催化剂 B.缩小容器的体积
C.降低CO2浓度 D.升高温度
II为探究硫在氧气中燃烧的产物里是否有SO3,某化学兴趣小组在绝热环境下进行了定量实验探究。探究实验的相关数据如下
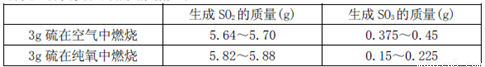
(3)对数据进行分析可知,等质量的硫在纯氧中燃烧产生的SO3比在空气中燃烧产生的SO3 (填“多”或“少”),原因可能是 。
A.纯氧中氧气浓度高,有利于化学平衡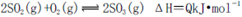 向右移动
向右移动
B.化学反应
C.纯氧中氧气浓度高,单位时间内发热量大,致使反应体系的温度较高,不利于化学平衡
 向右移动
向右移动
D.3g硫在纯氧中燃烧比3g硫在空气中燃烧放出的热量多,不利于化学平衡
 向右移动
向右移动
2012年冬季,我国城市空气污染状况受到人们的强烈关注,其中NOx、CO、SO2是主要污染性气体。
I.汽车内燃机工作时发生的反应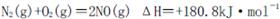 是导致汽车尾 气中含有NO的重要原因之一。
是导致汽车尾 气中含有NO的重要原因之一。
(1)有人欲选用合适的催化剂,使反应2NO(g)=N2(g)+O2(g)能较快进行以达到除去NO的目的。你认为该反应能否自发进行 (填“能”或“不能”)。
(2)利用催化技术可将汽车尾气中的NO气体转化成无毒气体,相关反应的平衡常数可表示为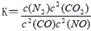 ,此反应为放热反应。在一定温度下,10L某密闭容器中发生上述反应,各物质的物质的量的变化情况如下表
,此反应为放热反应。在一定温度下,10L某密闭容器中发生上述反应,各物质的物质的量的变化情况如下表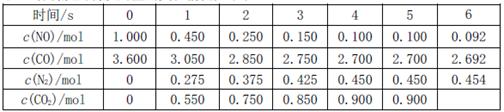
①根据土表数据计算0~4s间用NO表示的平均速率v(NO)= ;达到化学平衡时两种反应物的转化率是否相等 (填“相等”或“不相等”)。
②在5~6s时,若K增大,5s后正反应速率 (填“增大”或“减小”)
③在5~6s时,若K不变,以上各物质的物质的量变化原因可能是 。
A.选用更有效的催化剂 B.缩小容器的体积
C.降低CO2浓度 D.升高温度
II为探究硫在氧气中燃烧的产物里是否有SO3,某化学兴趣小组在绝热环境下进行了定量实验探究。探究实验的相关数据如下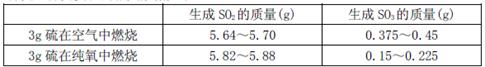
(3)对数据进行分析可知,等质量的硫在纯氧中燃烧产生的SO3比在空气中燃烧产生的SO3 (填“多”或“少”),原因可能是 。
A.纯氧中氧气浓度高,有利于化学平衡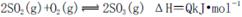 向右移动
向右移动
B.化学反应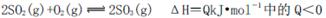
C.纯氧中氧气浓度高,单位时间内发热量大,致使反应体系的温度较高,不利于化学平衡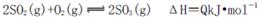 向右移动
向右移动
D.3g硫在纯氧中燃烧比3g硫在空气中燃烧放出的热量多,不利于化学平衡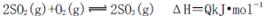 向右移动
向右移动
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com