I.下列说法正确的是
(填字母编号,每小题只有一个正确答案,下同)
A.离子晶体中一定存在离子键,分子晶体中一定存在共价键
B.主族元素形成的单质,从上到下熔沸点逐渐升高
C.N
2分子中的共价键是由两个σ键和一个π键组成的
D.以极性键结合的分子不一定是极性分子
II.下列叙述正确的是
.
A.用VSERP理论预测PCl
3的立体构型为平面三角形
B.SO
2和CO
2都是含有极性键的非极性分子
C.在NH
+4和[Cu(NH
3)
4]
2+中都存在配位键
D.铝元素的原子核外共有5种不同运动状态的电子
III.Q、R、X、Y、Z五种元素的原子序数逐渐增大.已知Z的原子序数为29,其余均为短周期主族元素.Y原子的价电子排布为ms
nmp
n.R原子核外L层的电子数为奇数,Q、X原子p轨道的电子数分别为2和4.请回答下列问题:
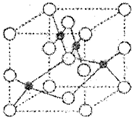
(1)Z
2+的核外电子排布式是
.如图是Z和X形成晶体的晶胞结构示意图(O代表X),可确定该晶胞中阴离子的个数为
.
(2)Q与Y形成的最简单气态氢化物分别为A、B,试比较它们的热稳定性并说明理由:
.
(3)Q和X形成的一种化合物甲的相对分子质量为44,则甲的空间构型是
,中心原子采取的杂化轨道类型是
,该分子中含有
个π键.
(4)R有多种氧化物,其中乙的相对分子质量最小.在一定条件下,2L的乙气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐的化学式是
.
(5)这五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于
晶体;Q、R、X三种元素的第一电离能数值由小到大的顺序为
(用元素符号作答)

