
题目列表(包括答案和解析)
|
氯气性质活泼,能够与大多数金属单质和非金属单质反应.下列说法不正确的是 | |
| [ ] | |
A. |
纯净的氢气可以在氯气中安静地燃烧,发出苍白色火焰,产生白雾 |
B. |
红热的铁丝、铜丝都可以在氯气中燃烧,生成棕黄色的烟 |
C. |
将氯气通入硫酸铜溶液中,可以使溶液的蓝色褪去 |
D. |
用氯气制漂白粉是为了得到易贮存的漂白剂 |
⑴近年来我国出现大范围雾霾天气,许多城市发布PM2.5重度污染警报。
①下列行为不会增加城市大气中PM2.5浓度的是 (填字母)。
a.燃放烟花爆竹 b.为城市主干道洒水保洁 c.露天焚烧落叶
②雾霾会刺激呼吸道,使人易患流行性感冒。感冒发烧病人可服用 药品进行治疗(填字母)。
a.麻黄碱 b.抗酸药 c.阿司匹林
③多食富含维生素C的蔬菜水果可增强人的免疫力。维生素C的结构简式是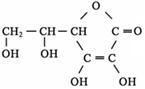 ,它的分子式是 。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有 性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是 ,说明维生素C具有 性。
,它的分子式是 。在维生素C溶液中滴入紫色石蕊试液,溶液颜色变红,说明维生素C溶液具有 性;在维生素C溶液中滴入少量蓝色的含有淀粉的碘水,可观察到的现象是 ,说明维生素C具有 性。
⑵今年1月12日,我国3名潜水员圆满完成首次300米饱和潜水作业,实现“下五洋捉鳖”的壮举。
①潜水员乘坐的潜水钟以钢铁为主要制造材料。钢铁容易在潮湿空气中发生电化学腐蚀,其负极的电极反应式是 。
②潜水员需要均衡的膳食结构。糖类、油脂、蛋白质都能为人体提供能量。某品牌高钙梳打的配料标签如图所示。在所列配料中,富含糖类的是 ,植物油在体内水解最终产物是高级脂肪酸和 。碳酸氢钠、碳酸钙可调节人体内的过多的胃酸,写出碳酸钙与胃酸反应的离子方程式为 。
③运载潜水钟的母船会产生大量废水和垃圾。科学实验的含汞离子废水 需要处理后再排放,可加入适量的硫化钠溶液,使汞离子变成 (填化学式)沉淀而除去;
⑶著名物理化学家张存浩院士获得2013年国家最高科学技术奖,他在氟化氢(氘)激光器和水煤气合成液体燃料研究等方面做出了重要贡献。
①氟化氢(HF)的水溶液能雕刻玻璃。制备普通玻璃的主要原料有SiO2、CaCO3、 (填化学式)。
②水煤气的主要成分是CO和H2,在40MPa、380℃、锌铬氧化物做催化剂的条件下,用CO和H2合成液体燃料CH3OH,该反应的化学方程式为 。
⑷材料的不断发展可以促进社会进步。
① “玉兔”号月球车开创了我国月球表面探索的先河,其制备材料中
使用了镁铝合金,选用镁铝合金的优点是 (任答一点)。
②碳化硅硬度很大,它属于 (填字母)。
a.金属材料 b.无机非金属材料 c.有机高分子材料
③随便丢弃用过的聚乙烯塑料膜会造成白色污染,写出由乙烯在催化剂作用下制备聚乙烯的化学方程式 ;
晶体硅是一种重要的非金属材料,制备纯硅的主要步骤为:①高温下用碳还原二氧化硅制得粗硅;②粗硅与干燥的HCl气体反应制得SiHCl3:Si+3HCl SiHCl3+H2;③SiHCl3与过量的氢气在1000℃~1100℃时反应制得纯硅。已知SiHCl3能与水剧烈反应,且在空气中易自燃。请回答下列问题:
SiHCl3+H2;③SiHCl3与过量的氢气在1000℃~1100℃时反应制得纯硅。已知SiHCl3能与水剧烈反应,且在空气中易自燃。请回答下列问题:
(1)第①步制备粗硅的化学方程式为___________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点为33.0℃)中含有少量的SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3常用的方法为____________。
(3)用SiHCl3与过量的氢气反应制备纯硅的装置如下图所示(热源及夹持装置略去)。
①装置B中的试剂是______,装置C中的烧瓶需要加热,其目的是________。
②反应一段时间后,装置D中观察到的现象是_________________,装置D不能采用普通玻璃管的原因是_______,装置D中发生反应的化学方程式为____
_____________________。
③为保证制备纯硅实验的成功,操作的关键是检验实验装置的气密性,控制好反应温度以及____________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需加入的试剂是__________(填写字母代号)。
a.碘水 b.氯水 c.NaOH溶液 d.KSCN溶液 e.Na2SO3溶液
(A)(10分)HN3称为叠氮酸,常温下为无色有刺激性气味的液体。N3—也被称为类卤离子。用酸与
 叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:
叠氮化钠反应可制得叠氮酸。而叠氮化钠可从下列反应制得:
NaNH2+N2O=NaN3+H2O。HN3、浓盐酸混合液可溶解铜、铂、金等不活泼
金属,如溶解铜生成CuCl2—。铜和铂的化合物在超导和医药上有重要应用,
Cu的化合物A(晶胞如图)即为超导氧化物之一,而化学式为Pt(NH3)2Cl2
的化合物有两种异构体,其中B异构体具有可溶性,可用于治疗癌症。试
回答下列问题:
(1)基态氮原子核外电子排布的轨道表示式为 。
(2)元素N、S、P的第一电离能(I1)由大到小的顺序为 。
(3)HN3属于 晶体,N3—的空间构型是_____,与N3—互为等电子体的分子的化学式为 (写1种)。NH2—的电子式为 ,其中心原子的杂化类型是 。
(4)CuCl2—中的键型为 ,超导氧化物A的化学式为
(5)治癌药物B的结构简式为
(B)(10分)以下是以绿矾、碳酸氢铵和氯化钾为原料制备生产市场较紧俏的硫酸钾产品的新工艺 。已知:反应(Ⅰ)的化学方程式为:FeSO4??7H2O+2NH4HCO3= FeCO3↓+(NH4)2SO4+CO2↑+H2O
反应(Ⅱ)的化学方程式为:(NH4)2SO4+2KC1=K2SO4+ 2NH4Cl
工艺流程如下:
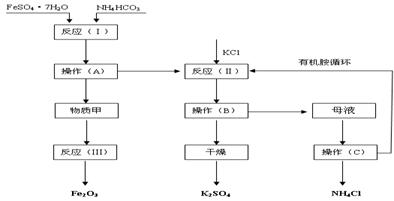
试回答下列问题:
(1)该工艺中的副产品是 。(填化学式)
(2)操作C的名称为 。
(3)原料绿矾、碳酸氢铵的最佳投料比是 (质量比)时,FeSO4的转化率大于95%。
(4)物质甲是 (填化学式),反应(Ⅲ)是甲物质与适量空气煅烧,温度为700~800℃,煅烧时间为1~1.5 h时可获得符合国标一级品要求的氧化铁红,其化学方程式是__________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com