
题目列表(包括答案和解析)
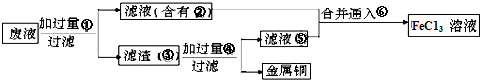


铁、铜、铝及其化合物应用广泛,是人们生活中常用的材料.
(1)
在电子工业中,制印刷电路时,常用氯化铁溶液作为铜的“腐蚀液”,该过程发生的反应为:2FeCl3+Cu 2FeCl2+CuCl2.该反应中铜作________剂.
2FeCl2+CuCl2.该反应中铜作________剂.
(2)日常用的铝制品比铁制品更耐腐蚀的原因是________.
(3)氢氧化铝是医用的胃酸中和剂的一种.试用离子方程式表示其作用机理:
________
.(4)超细氮化铝粉末被广泛应用于大规模集成电路生产等领域,其制取原理为:
Al2O3+N2+3C 2AlN+3CO
2AlN+3CO
(5)合成氨工业生产中所用的α
-Fe催化剂的主要成分是FeO、Fe2O3.当催化剂中Fe2+与Fe3+的物质的量之比为1∶2时,其催化活性最高,此时铁的氧化物混合物中铁的质量分数为________(用小数表示,保留
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com