
题目列表(包括答案和解析)
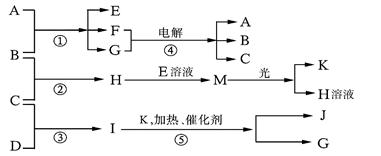
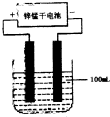
由短周期元素形成的六种微粒,有4种离子,两种分子,其中A、F是由非金属元素的原子构成的阳离子,这六种微粒均具有10个电子,它们间的相互关系如下:
a.A、B两种离子在加热条件下,可生成C、D两种分子
b.C是常温下呈气态的分子,遇Cl2时可冒白烟
c.E、B两种离子相互作用可生成2个D的分子
d.含F微粒的溶液,遇B会产生白色沉淀W、B过量时,W又可溶解变为无色溶液;在此无色溶液中加入E时,又产生白色沉淀W,E过量时,W又转化为F.
根据以上事实,回答以下各问:
(1)写出A+B![]() C+D的化学方程式
C+D的化学方程式
________________________
(2)C遇Cl2冒白烟的化学方程式是
________________________
(3)写出E、B反应生成2D的离子方程式
________________________
(4)F微粒的符号是________,白色沉淀W的化学式是________W溶于B的产物与E又生成W的离子方程式是________
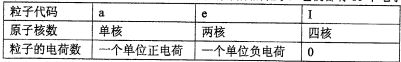
已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
| 粒子代码 | a | I | e |
| 原子核数 | 单核 | 四核 | 双核 |
| 粒子的电荷数 | 一个单位正电荷 | 0 | 一个单位负电荷 |



| ||
| ||


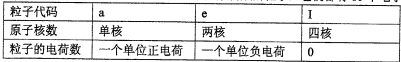
| 粒子代码 | a | e | I |
| 原子核数 | 单核 | 两核 | 四核 |
| 粒子的电荷数 | 一个单位正电荷 | 一个单位负电荷 | 0 |
 的电子式______;
的电子式______;湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com