铁合金及铁的化合物在生产、生活中有着重要的用途.
(1)已知铁是26号元素,写出Fe
2+的电子排布式
.
(2)已知三氯化铁固体在300℃以上可升华成含二聚三氯化铁(Fe
2Cl
6)分子的气体,该分子中所有原子均满足最外层8电子的稳定结构,则该分子的结构式为
,你认为该分子是否为平面形分子?
.
(3)六氰合亚铁酸钾K
4[Fe(CN)
6]俗称黄血盐,它可用做显影剂,该化合物中存在的化学键类型有
(从下列选项中选填:A.离子键 B.共价键 C.金属键 D.配位键 E.氢键).黄血盐在溶液中可电离出极少量的CN
-,CN
-与
互为等电子体(填一种即可).CN
-还可与H
+结合形成一种弱酸--氢氰酸(HCN),HCN分子中碳原子的杂化轨道类型是
,该分子的键α和π键数目分别为
.
(4)黄血盐溶液与Fe
3+反应可生成一种蓝色沉淀,该物质最早由1704年英国普鲁士的一家染料厂的工人发现,因此取名为普鲁士蓝,化学式可表示为K
xFe
y(CN)
z.研究表明它的晶体的结构特征是Fe
2+、Fe
3+分别占据立方体的顶点,且自身互不相邻,而CN
-位于立方体的棱上与Fe
2+、Fe
3+配位,K
+填充在上述微粒形成的部分空隙中.忽略K
+,该晶体的结构示意图如下四幅图所示:
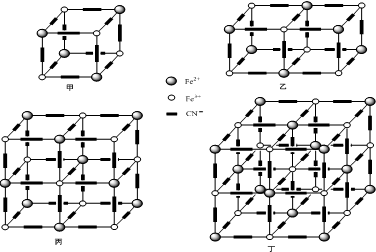
根据甲图可得普鲁士蓝的化学式为
,忽略K
+,上述四幅晶体结构图中,图
是普鲁士蓝的晶胞.若把CN
-看成直线,则该晶胞与《选修3》教材上的
(填化学式)的晶胞结构图高度类似.

