(1)写出0.1mol/LNa
2S溶液中的守恒关系,电荷守恒为
c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)
c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)
,物料守恒为
c(Na+)=2(HS-)+2c(H2S)+2c(S2-)
c(Na+)=2(HS-)+2c(H2S)+2c(S2-)
,溶液中各离子浓度的大小关系为
c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
.
(2)25℃时、有pH为a的HCl溶液和pH为b的NaOH溶液,取VaL该盐酸用该NaOH溶液中和,需V
bLNaOH溶液,(题中a<b,b≥8)问:
①若a+b=14,则
=
1:1
1:1
;
②若a+b=13,则
=
1:10
1:10
;
③若a+b>14,则
=
10a+b-14
10a+b-14
且Va
>
>
V
b(填“>”“<”“=”).

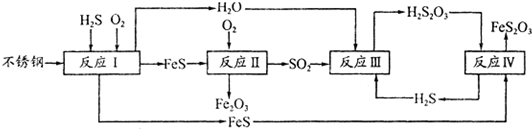
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+