
题目列表(包括答案和解析)
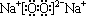
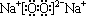
A、B、C、D四种短周期元素,A、B、C同周期,A的原子半径是同周期中最大的;B、D同主族。已知D元素的一种单质是日常生活中饮水机常用的消毒剂,C元素的单质可以从A、B两元素组成的化合物的水溶液中置换出B元素的单质。
(1)C元素在周期表中的位置 。
(2)A、B元素形成的常见化合物水溶液显 性,原因是(用离子方程式表示)
;这种化合物水溶液的pH比A2BD3水溶液的pH (填“大”或“小”),用文字简要说明原因 。
(3)A、B元素还可以形成化合物A2B2,请根据同族元素及其他合物组成和结构相似则性质相似的特点,推测并写出A2B2与稀盐酸反应的化学方程式 (用元素符号表示)。
(4)B元素的单质在不同的条件下可以与O2发生一系列反应:
B(s)+O2(g)=BO2(g);△H=-296.8kJ?mol-1
2BO2(s)+O2(g) ![]() 2BO3(g);△H=-196.6kJ?mol-1
2BO3(g);△H=-196.6kJ?mol-1
则1 mol BO3(g)若完全分解成B(s),反应过程中的热效应为 。
已知A、B、C、D、E、F、G位于元素周期表的前四周期,且元素原子序数依次增加,A焰色反应呈黄色;工业常用电解B的熔融的氯化物来制备B,C是一种能被HF和NaOH溶液溶解的单质,D的电负性比磷大,第一电离能却比磷小,E单质是制备漂白液的原料,F能形成红色(或砖红色)和黑色的两种氧化物,G是一种主族金属。
(1)前四周期所有元素中,基态原子中未成对电子与其所在周期数相同的元素有 种。
(2)元素A、B、C分别与氟气化合形成物质X、Y、Z熔点见下表:
| 氟化物 | X | Y | Z |
| 熔点/K | 1266 | 1534 | 183 |
已知甲、乙、丙为常见单质,A、B、C、D、E、F、G、X均为常见的化合物;B和X的摩尔质量相同,E的相对分子质量比D的相对分子质量大16,在一定条件下,各物质相互转化关系如下图所示:
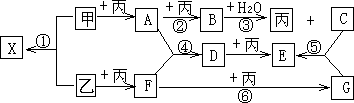
(1)写出X的电子式________;以上物质中具有漂白作用的有(填写化学式)________、________;
(2)以上①②③④⑤⑥的六个转化中,属于化合反应,但不属于氧化还原反应的是(填写编号)________;
(3)写出D→E的化学方程式:________;
(4)同类物质的化学性质具有相似性,也有特殊性.请写出物质B与F反应的可能的化学方程式:________,你这样书写的理由是:_________________________.
(1) 已知在一定条件下的反应4HCl+O2=2Cl2 +2H2O中, 有4mol HCl被氧化时,放出120kJ的热量,且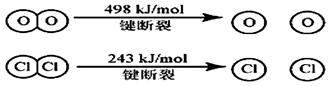
则断开1 mol H—O 键与断开 1 mol H—Cl 键所需能量相差为__________KJ。
(2)科学家通过X射线探明,NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(kJ·mol-1) | 786 | 715 | 3401 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com