在学了盐的性质以后,某校化学兴趣小组的同学开展了测定Na
2CO
3和NaCl的固体混合物中质量分数的探究实验.他们设计了如下的实验方案:
[方案一]气体分析法.
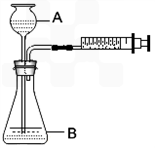
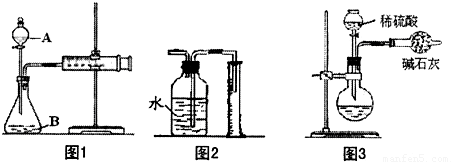
(1)如下图1所示(铁夹夹持的仪器是注射器),把X g的混合物与足量稀硫酸反应后,测定产生的CO
2气体的体积.检查该装置的气密性的方法是
若装置漏气,拉出的活塞不移动,若不漏气,拉出的活塞应回到原来的位置
若装置漏气,拉出的活塞不移动,若不漏气,拉出的活塞应回到原来的位置
.
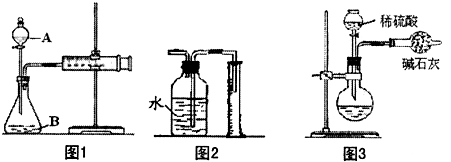
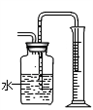
(2)有同学提出以图2代替图1中的收集装置,则所测CO
2气体的体积
偏小
偏小
(填“偏大”、“偏小”、“不变”),理由是
CO2能溶于水且与水反应
CO2能溶于水且与水反应
,你的改进方案是
将广口瓶中的水改为饱和的CO2水溶液(或在水面上覆盖一层植物油)
将广口瓶中的水改为饱和的CO2水溶液(或在水面上覆盖一层植物油)
;广口瓶内原有的空气对实验结果
没有
没有
(填“有”或“没有”)影响.
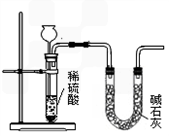
(3)也有人用图3装置测定CO
2的质量 (碱石灰的成分是CaO和NaOH的混合物,可吸收CO
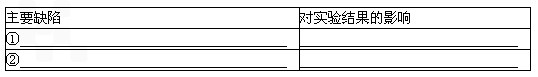
2气体).则图3实验装置主要存在哪些缺陷?这些缺陷对实验结果有何影响?(选2点填入下表)
| 主要缺陷 |
对实验结果的影响 |
| ① 产生的CO2气体中混有水蒸气,同时被碱石灰吸收 产生的CO2气体中混有水蒸气,同时被碱石灰吸收 |
导致结果偏大 导致结果偏大 |
| ② 反应结束后装置内残留的CO2气体不能全部排出 反应结束后装置内残留的CO2气体不能全部排出 |
导致结果偏小 导致结果偏小 |
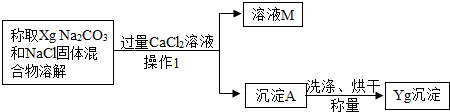
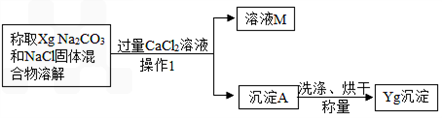
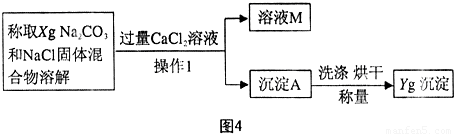
[方案二]沉淀分析法 (如图4所示).则:
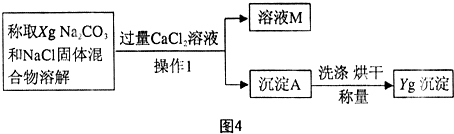
(1)“操作1”的名称是
过滤
过滤
.
(2)确定CaCl
2溶液是否过量的方法是
静置,向上层清液中继续滴加CaCl2溶液,若无沉淀说明CaCl2溶液已过量
静置,向上层清液中继续滴加CaCl2溶液,若无沉淀说明CaCl2溶液已过量
.
(3)导致测定的结果偏大的原因可能是
沉淀未洗涤干净(或沉淀干燥不充分)
沉淀未洗涤干净(或沉淀干燥不充分)
.