
题目列表(包括答案和解析)
铁是一种典型的过渡金属,铁和铁的化合物在生产和生活中有广泛的应用。完成下列计算:
(1)将11.802 g钢样粉末(只含铁和碳)于高温下置于足量的纯氧中充分反应,冷却后得到16.240 g磁性氧化铁。
①钢样中含铁________g。
②生成的CO2在标准状况下体积为________mL。
(2)向10 mL氯化铁溶液(含盐酸0.001 mol)中加入16.8 g 5%的烧碱溶液(足量),充分反应后过滤。洗涤沉淀,将洗涤液与滤液合并后稀释至250mL。取25mL稀释液,用0.100 mol/L盐酸滴定,终点时消耗盐酸的体积15.50mL。计算原溶液中Fe3+的物质的量浓度。
(3)铁锈的主要成分实为羟基氧化铁[化学式FeO(OH)]。将一块带锈铁片放入700mL pH=0的稀硝酸中充分反应,收集到标准状况下NO气体3.584 L,最终剩余2.020g铁。求:
①反应后溶液中溶质的成分与物质的量。
②原带锈铁片中铁锈的质量分数。
(4)用FeSO4和NaOH制备Fe(OH)2时,往往会形成一种灰绿色的中间物(用X表示)。经分析,X中含有三种阴离子与两种阳离子,阴、阳离子的总质量之比为11:12。已知两种阳离子为Fe2+与Fe3+,物质的量之比为2:1。请通过计算确定X的化学式。
铁是一种典型的过渡金属,铁和铁的化合物在生产和生活中有广泛的应用.完成下列计算∶
1.将11.802 g钢样粉末(只含铁和碳)于高温下置于足量的纯氧中充分反应,冷却后得到16.240 g磁性氧化铁.
(1)钢样中含铁________g.
(2)生成的CO2在标准状况下体积为________mL.
2.向10 mL氯化铁溶液(含盐酸0.001 mol)中加入16.8 g 5%的烧碱溶液(足量),充分反应后过滤.洗涤沉淀,将洗涤液与滤液合并后稀释至250 mL.取25 mL稀释液,用0.100 mol/L盐酸滴定,终点时消耗盐酸的体积15.50 mL.计算原溶液中Fe3+的物质的量浓度.
3.铁锈的主要成分实为羟基氧化铁[化学式FeO(OH)].将一块带锈铁片放入700 mL pH=0的稀硝酸中充分反应,收集到标准状况下NO气体3.584 L,最终剩余2.020 g铁.求∶
(1)反应后溶液中溶质的成分与物质的量.
(2)原带锈铁片中铁锈的质量分数.
4.用FeSO4和NaOH制备Fe(OH)2时,往往会形成一种灰绿色的中间物(用X表示).经分析,X中含有三种阴离子与两种阳离子,阴、阳离子的总质量之比为11∶12.已知两种阳离子为Fe2+与Fe3+,物质的量之比为2∶1.请通过计算确定X的化学式.
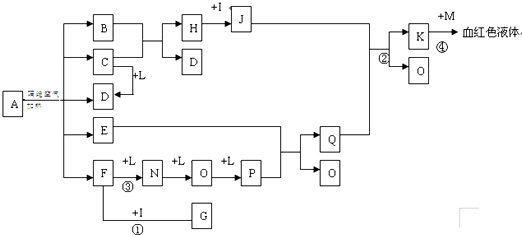
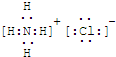
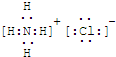
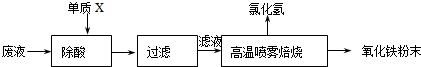
| ||
| ||
| 操作步骤 | 预期现象和结论 |
| 步骤1.取少量样品于试管中, 加入足量的3mol?L-1H2SO4,充分振荡 加入足量的3mol?L-1H2SO4,充分振荡 |
样品全部溶解 样品全部溶解 |
| 步骤2. 取少许溶液于试管中,加入足量铁粉,充分振荡;再加入足量3mol?L-1H2SO4,充分振荡 取少许溶液于试管中,加入足量铁粉,充分振荡;再加入足量3mol?L-1H2SO4,充分振荡 |
试管中出现红色固体,说明试样中有CuO 试管中出现红色固体,说明试样中有CuO |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 22400 |
| 63.5 |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 36.5V |
| 22.4 |
| 22400 |
| 63.5 |
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
| pH值 | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 |
| 温度/℃ | 10 | 30 | 40 | 50 | 60 |
| CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
| MgSO4?7H2O | 30.9 | 35.5 | 40.8 | 45.6 | / |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com