
题目列表(包括答案和解析)
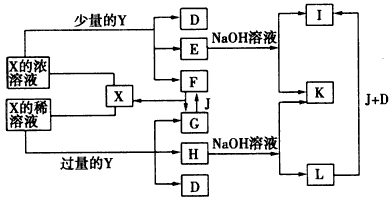
 如图所示,A、G、I均为单质,其中A、G为金属且都常被用作输电线,且G单质有特殊颜色,B为黑色粉末,L是由两种元素组成的盐,它是家庭厨房必备物品.请回答:
如图所示,A、G、I均为单质,其中A、G为金属且都常被用作输电线,且G单质有特殊颜色,B为黑色粉末,L是由两种元素组成的盐,它是家庭厨房必备物品.请回答:
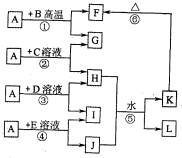
(14分) 下图各物质中,A、B、C是常见金属单质,甲、乙、丙是气体且乙是有特殊颜色的气体(图中有些反应的产物和反应的条件没有全部标出)。
请根据以上信息回答下列问题:
(1)写出:H的化学式_________,乙的两种重要用途________________________________
(2)写出有关反应的离子方程式:
反应①__________________________________________________________
反应②__________________________________________________________
(3)判断反应③己经发生的常用试剂是______________________
(4)胶态磁流体(液溶胶)在医学上有重要用途,C单质对应元素的某种纳米级氧化物是磁流体中的重要粒子,该磁流体的主要制备过程如下:(Ⅰ)将NH3通入F、G的混合溶液(F、G物质的量比为1:2)中会生成两种碱。(Ⅱ)这两种碱恰好反应就得到该氧化物。写出(Ⅱ)中反应的化学方程式为:_________________________,确定该磁流体己成功制取的方法_________________________________
现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D原子核外哑铃形原子轨道上有2个未成对电子,D与A形成的化合物分子构型是V型。B元素是形成化合物种类最多的元素,A、B的最外层电子数之和与C的最外层电子数相等,F是同周期第一电离能最小的元素。
(1)写出C元素基态原子的价电子排布式 ;B、C、D三种元素电负性由大到小的顺序为(用元素符号表示) ;
(2)E与A能形成分子式为EA的化合物。接近EA沸点的EA蒸气的相对分子质量测量值要大于其分子计算值,原因是 ;C、D分别与A形成最简单分子中,稳定性较高的是 (填化学式)分子;该分子再与A+结合成离子时,ACA键的键角会 (填“变大”、“不变”或“变小”)
(3)C与F形成的化合物FC3中,C3的空间构型为 ,C3—中心原子采用 杂化。灼烧FC3时,火焰呈现特殊颜色,请从原理上解释产生该现象的原因: 。
(4)右图为B元素的某种单质晶体的晶胞,则该晶体中B原子的空间占有率为 (用r表示B的原子半径,用带r的表达式表示,不必简化)

(14分)下图各物质中,A、B、C是常见金属单质,甲、乙、丙是气体且乙是有特殊颜色的气体(图中有些反应的产物和反应的条件没有全部标出)。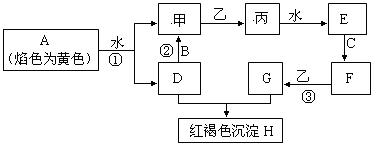
请根据以上信息回答下列问题:
(1)写出:H的化学式_________,乙的两种重要用途________________________________
(2)写出有关反应的离子方程式:
反应①__________________________________________________________
反应②__________________________________________________________
(3)判断反应③己经发生的常用试剂是______________________
(4)胶态磁流体(液溶胶)在医学上有重要用途,C单质对应元素的某种纳米级氧化物是磁流体中的重要粒子,该磁流体的主要制备过程如下:(Ⅰ)将NH3通入F、G的混合溶液(F、G物质的量比为1:2)中会生成两种碱。(Ⅱ)这两种碱恰好反应就得到该氧化物。写出(Ⅱ)中反应的化学方程式为:_________________________,确定该磁流体己成功制取的方法_________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com