
题目列表(包括答案和解析)
(15分)元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为 。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是 (填序号)。
a.Cl2、Br2、I2的熔点 b. Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的热稳定性 d. HCl、HBr、HI的酸性
(3)工业上,通过如下转化可制得KClO3晶体:
NaCl溶液 NaClO3溶液
NaClO3溶液 KClO3晶体
KClO3晶体
①完成I中反应的总化学方程式:□NaCl+□H2O=□NaClO3+□ 。
②Ⅱ中转化的基本反应类型是 ,该反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
(4)一定条件,在水溶液中1 mol Cl-、ClO-(x=1,2,3,4)的能量(KJ)相对大小如右图所示。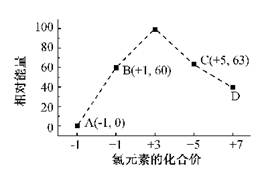
①D是 (填离子符号)。
②B→A+C反应的热化学方程式为 (用离子符号表示)。
 我国的四大发明之一黑火药,爆炸时发生反应的化学方程式为:S+2KNO3+3C→K2S+3CO2↑+N2↑.请根据其中所含的元素回答下列问题:
我国的四大发明之一黑火药,爆炸时发生反应的化学方程式为:S+2KNO3+3C→K2S+3CO2↑+N2↑.请根据其中所含的元素回答下列问题:pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |

现有A、B、C、D、E、F六种中学常见的元素,其原子序数依次增大。①D的一种含氧酸根离子与H+结合生成D的单质、D的氧化物和水;该D的氧化物通入品红溶液,溶液褪色,加热溶液又变红色;②在短周期元素中,只有C的氧化物和烧碱反应生成的溶液与过量盐酸混合产生白色沉淀;③A与D的原子最外层电子数相同;④B的单质既能与盐酸反应,又能与氢氧化钠溶液反应;⑤E有多种含氧酸,其氧化性与“同元素价态越高,其氧化性越强”一般规律相悖,它是生活调味品和农药的组成元素 ⑥E单质+F单质![]() 红棕色烟,D单质+F单质
红棕色烟,D单质+F单质![]() 黑色固体,A单质+F单质
黑色固体,A单质+F单质![]() 黑色固体。F的最高价钾盐是一种绿色环保型净水剂。
黑色固体。F的最高价钾盐是一种绿色环保型净水剂。
根据上述信息,回答下列问题:
(1)A的简单离子结构示意图为 ;具有强氧化性的E的含氧酸结构式为 ;
(2)向一定量的烧碱溶液中缓慢通入DA2,得到中性溶液,其溶质的化学式为 ;
(3)下列“根据”能证明B、F单质活泼性强弱的是 ;
a.根据它们分别与D单质反应产物的价态
b.根据它们最高价氧化物的水化物在氢氧化钠溶液中溶解情况
c.根据它们分别与盐酸反应产生气泡快慢
d.根据它们在空气中稳定性
(4)工业上冶炼C单质的化学方程式为 。
(5)CE4在湿空气中产生大量白雾,可以用于海战。写出发生的化学方程式: 。
(6)C、D、E最高价氧化物对应的水化物酸性强弱顺序为(用化学式表示): 。
 (2012?东城区一模)臭氧是一种强氧化剂,常用于消毒、灭菌等.
(2012?东城区一模)臭氧是一种强氧化剂,常用于消毒、灭菌等.pH t/min T/℃ |
3.0 |
4.0 |
5.0 |
6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com