
题目列表(包括答案和解析)

| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
| c(CH3OH)?c(H2O) |
| c(CO2)?c3(H2) |
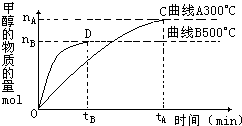
 A.在300℃,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=
A.在300℃,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=| nA |
| tA |
| n(H2) |
| n(CH3OH) |
| 3 |
| 2 |
| 3 |
| 2 |

| nA |
| tA |
| n(H2) |
| n(CH3OH) |
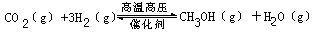

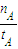 mol?-1
mol?-1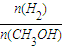 增大
增大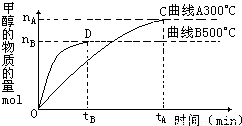
2009年12月7日~18日在丹麦首都哥本哈根召开了世界气候大会,商讨《京都议定书》一期承诺到期后的后续方案,即2012年至2020年的全球减排协议,大会倡导“节能减排” 和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。过渡排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
 CO2(g)+3H2(g)
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图表示该反应过程中能量(单位为kJ·mol-1)的变化:

(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
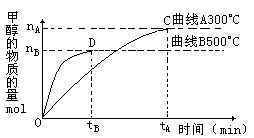
(2)为探究反应原理,现进行如下实验,在体积为l L的密闭容器中,充入l mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),经测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g),经测得CO2和CH3OH(g)的浓度随时间变化如图所示。

从反应开始到平衡,CO2的平均反应速率v(CO2) = 。
② 该反应的平衡常数表达式K= 。
③ 下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l molCO2和3 molH2
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出369.2kJ的热量,写出该反应的热化学方程式:___________________________________________。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入或通入的物质有__________ _____;其正极的电极反应式是:_____________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com