
题目列表(包括答案和解析)
(16分)
(1)1840年前后,瑞士科学家盖斯(Hess)指出,一个化学反应的热效应,仅与反应物的最初状态及生成物的最终状态有关,而与中间步骤无关,这就是著名的“盖斯定理”。现已知,在101 kPa下,CH4(g)、H2(g)、C(s)的燃烧热分别为890.3 kJ·mol-1、285.8 kJ·mol-1和393.5 kJ·mol-1,则反应C(s)+2H2(g)= CH4(g)的反应热ΔH=__________,根据以上信息,你认为“盖斯定理”在我们确定一些化学反应的反应热时有何重要意义?__________。
(2)已知:2H2(g)+O2(g)====2H2O(g) ΔH1
2H2(g)+O2(g) ====2H2O(l) ΔH2
2CO(g)+O2(g)====2CO2(g) ΔH3
①写出液态水转化为气态水的热化学方程式:___________________________________。
②CO和H2分别燃烧生成CO2(g)和H2O(g),欲得到相同热量,所需CO和H2的体积比是__________。
(16分)(1)已知:
Fe(s)+1/2O2(g)=FeO(s) 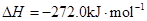
2Al(s)+3/2O2(g)= Al2O3(s) 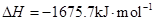
Al和FeO发生铝热反应的热化学方程式是_____________________________________。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如下图所示。

①据图判断该反应是_____(填“吸”或“放”) 热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率__ _ _ (填“增大”、“减小”或“不变”)
②其中B历程表明此反应采用的条件为______ (选填下列序号字母)
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用了催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)
+ 4H2(g)  Na2S(s)
+ 4H2O(g) 。
Na2S(s)
+ 4H2O(g) 。
①该反应的平衡常数表达式为____________________。已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。
②用有关离子方程式说明上述反应所得固体产物的水溶液的酸碱性____________
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,请回答下列问题:
①混合溶液中水电离出的c(H+)与0.1mol·L-1NaOH溶液中水电离出的c(H+)比较
(填<、>、=)。
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填<、>、=);相同温度下,等物质的量浓度的下列盐溶液按pH由大到小的排列顺序为 。(填序号)
a..NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
(16分)(1)已知:
Fe(s)+1/2O2(g)=FeO(s) ![]()
2Al(s)+3/2O2(g)= Al2O3(s) ![]()
Al和FeO发生铝热反应的热化学方程式是_____________________________________。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如下图所示。
①据图判断该反应是_____(填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率__ _ _ (填“增大”、“减小”或“不变”)
②其中B历程表明此反应采用的条件为______ (选填下列序号字母)
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用了催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)+ 4H2(g) Na2S(s)+ 4H2O(g) 。
①该反应的平衡常数表达式为____________________。已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。
②用有关离子方程式说明上述反应所得固体产物的水溶液的酸碱性____________
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,请回答下列问题:
①混合溶液中水电离出的c(H+)与0.1mol·L-1NaOH溶液中水电离出的c(H+)比较
(填<、>、=)。
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填<、>、=);相同温度下,等物质的量浓度的下列盐溶液按pH由大到小的排列顺序为 。(填序号)
a..NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
(16分)(1)已知:
Fe(s)+1/2O2(g)=FeO(s) 
2Al(s)+3/2O2(g)= Al2O3(s) 
Al和FeO发生铝热反应的热化学方程式是_____________________________________。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如下图所示。
①据图判断该反应是_____(填“吸”或“放”) 热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率__ _ _ (填“增大”、“减小”或“不变”)
②其中B历程表明此反应采用的条件为______ (选填下列序号字母)
A.升高温度 B.增大反应物的浓度
C.降低温度 D.使用了催化剂
(3)1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g)  Na2S(s) + 4H2O(g) 。
Na2S(s) + 4H2O(g) 。
①该反应的平衡常数表达式为____________________。已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。
②用有关离子方程式说明上述反应所得固体产物的水溶液的酸碱性____________
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,请回答下列问题:
①混合溶液中水电离出的c(H+)与0.1mol·L-1NaOH溶液中水电离出的c(H+)比较
(填<、>、=)。
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填<、>、=);相同温度下,等物质的量浓度的下列盐溶液按pH由大到小的排列顺序为 。(填序号)
a..NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
(16分)(1)在容积为VL的密闭容器中发生2NO2(g)![]() 2NO(g)+O2(g)的反应。
2NO(g)+O2(g)的反应。 反应过程中NO2的物质的量随时间变化的状况如图所示。
反应过程中NO2的物质的量随时间变化的状况如图所示。
①不能说明该反应已达到平衡状态的是 ( )
A.V正(NO2)=2V逆(O2)
B.C(NO2)=C(NO)
C.气体的平均摩尔质量不变
D.NO的体积分数保持不变
②若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是( )
A.有、无催化剂 B.温度不同 C.压强不同
③写出该反应的化学平衡常数K的表达式________________,并比较K800℃________________K850℃ (填>、<或=)。
(2)在以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
①C+H2O(g)![]() CO+H2;
CO+H2;
②CO+H2O(g)![]() CO2+H2 ;
CO2+H2 ;
已知CO(g)+1/2O2(g)=CO2(g);△H=-283.0kJ/mol ;
H2(g)+1/2O2(g)=H2O(g); △H=-285.8kJ/mol;写出上述CO与H2O(g)反应的热化学方程式。
![]() (3)处理含汞废水的方法很多。下面是常用的两种方法,汞的回收率很高。
(3)处理含汞废水的方法很多。下面是常用的两种方法,汞的回收率很高。
![]()
① 置换法:用废铜屑处理含Hg2+的废水。反应的离子方程式为________________。
② 化学沉淀法:用硫化钠处理含Hg(NO3)2的废水,生成HgS沉淀。已知Ksp(HgS) =1.6×10―52,当废水中c(S2―)=1×10―5mol/L时,c(Hg2+)=________________ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com