
题目列表(包括答案和解析)
某校化学研究性学习小组的同学在学习了氨的性质持讨论:运用类比的思想,既然氨气具有还原性,能否像H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题.请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)写出实验制取氨气的化学方程式________;
(2)在实验室中,还可以用浓氨水与________(填写一种试剂)快速制取少量氨气;
(3)有同学模仿排饱和食盐水收集氯气的方法,想用排饱和氯化铵溶液的方法收集氨气.
你认为他能否达到目的?________(填“能”或“否”),理由是____________.
(二)实验探究
该小组中某同学设计了下图所示的实验装置(夹持及尾气处理装置未画出),探究氨气的还原性:

该装置在设计上有一定缺陷,可以采取的的改进措施是__________________.
利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的N2.
(三)问题讨论
(1)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O.已知:Cu2O是一种碱性氧化物;在酸性溶液中,Cu+的稳定性比Cu2+差(Cu+→Cu+Cu2+).请你设计一个简单的实验检验该红色物质中是否含有Cu2O.________;
(2)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是
他们进行了如下实验:取98 g Cu(OH)2固体,加热至80℃~100℃时,得到黑色固体粉末,继续加热到1 000℃以上,黑色粉末全部变为红色粉末A.冷却后称量,A的质量为72 g.据此可推得,A的化学式为________.由此,得到的结论是________.
(四)兴趣探究
将铜丝的一端绕成螺旋状,在酒精灯外焰加热,冷却后变黑.再在酒精灯上将该铜丝加热至红热状态.如下图所示,趁热插入到试管里的氯化铵晶体中,在试管中出现白烟.冷却后取出铜丝变成亮红色.

(1)试管中出现白烟的有关化学方程式为____________.
(2)铜丝灼热后在氯化铵中由黑变红的有关化学方程式___________.
某研究性学习小组进行溴乙烷的制备及性质探究实验。

探究一:该小组制备溴乙烷的步骤如下:
① 向装置图所示的U形管和大烧杯中加入冷水;
② 在小烧杯中按照一定比例配制乙醇、水、浓硫酸的混合液;
③ 向装置图所示的圆底烧瓶中加入一定量研细的溴化钠粉末和少量碎瓷片;
④ 将冷却至室温的混合液转移到圆底烧瓶中,加热;
⑤ 制取溴乙烷。
回答下列问题:
(1)步骤②向乙醇和水中缓缓加入浓硫酸时,小烧杯要置于冷水中冷却,除了避免硫酸小液滴飞溅外,更主要的目的是:_____________________________________
(2)步骤④加热片刻后,烧瓶内的混合物出现橙红色,出现这种现象的原因是(请用化学反应方程式表示):____________________________________________________
改用小火加热后,橙红色会逐渐消失,消失的原因是(请用化学反应方程式表示):
______________________________________________________
(3)为了更好地控制反应温度,除用图示的小火加热,还可采用的加热方式是__________。
(4)步骤⑤反应结束后,将U形管中的混合物倒入分液漏斗中,静置,待液体分层后, 弃去____________(填“上层”或“下层”)液体。为了除去粗产品中的杂质,可用下列试剂中的_____________(填序号)
A. 氢氧化钠稀溶液 B. 碳酸钠稀溶液
C. 硝酸银溶液 D. 四氯化碳
探究二:学习小组在进行溴乙烷与NaOH乙醇溶液的反应实验中,观察到有气体生成。他们设计了两种不同的方法分别检验该气体,实验装置如图
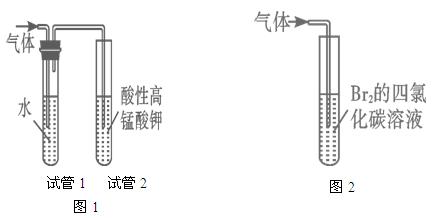
请回答:
(5)图1中,试管1的作用是:________________________________;
图2中发生的反应是:________________________________(用化学方程式表示)。
某研究性学习小组进行溴乙烷的制备及性质探究实验。
探究一:该小组制备溴乙烷的步骤如下:
① 向装置图所示的U形管和大烧杯中加入冷水;
② 在小烧杯中按照一定比例配制乙醇、水、浓硫酸的混合液;
③ 向装置图所示的圆底烧瓶中加入一定量研细的溴化钠粉末和少量碎瓷片;
④ 将冷却至室温的混合液转移到圆底烧瓶中,加热;
⑤ 制取溴乙烷。
回答下列问题:
(1)步骤②向乙醇和水中缓缓加入浓硫酸时,小烧杯要置于冷水中冷却,除了避免硫酸小液滴飞溅外,更主要的目的是:_____________________________________
(2)步骤④加热片刻后,烧瓶内的混合物出现橙红色,出现这种现象的原因是(请用化学反应方程式表示):____________________________________________________
改用小火加热后,橙红色会逐渐消失,消失的原因是(请用化学反应方程式表示):
______________________________________________________
(3)为了更好地控制反应温度,除用图示的小火加热,还可采用的加热方式是__________。
(4)步骤⑤反应结束后,将U形管中的混合物倒入分液漏斗中,静置,待液体分层后, 弃去____________(填“上层”或“下层”)液体。为了除去粗产品中的杂质,可用下列试剂中的_____________(填序号)
A. 氢氧化钠稀溶液 B. 碳酸钠稀溶液
C. 硝酸银溶液 D. 四氯化碳
探究二:学习小组在进行溴乙烷与NaOH乙醇溶液的反应实验中,观察到有气体生成。他们设计了两种不同的方法分别检验该气体,实验装置如图
请回答:
(5)图1中,试管1的作用是:________________________________;
图2中发生的反应是:________________________________(用化学方程式表示)。
某研究性学习小组进行溴乙烷的制备及性质探究实验。

探究一:该小组制备溴乙烷的步骤如下:
① 向装置图所示的U形管和大烧杯中加入冷水;
② 在小烧杯中按照一定比例配制乙醇、水、浓硫酸的混合液;
③ 向装置图所示的圆底烧瓶中加入一定量研细的溴化钠粉末和少量碎瓷片;
④ 将冷却至室温的混合液转移到圆底烧瓶中,加热;
⑤ 制取溴乙烷。
回答下列问题:
(1)步骤②向乙醇和水中缓缓加入浓硫酸时,小烧杯要置于冷水中冷却,除了避免硫酸小液滴飞溅外,更主要的目的是:_____________________________________
(2)步骤④加热片刻后,烧瓶内的混合物出现橙红色,出现这种现象的原因是(请用化学反应方程式表示):____________________________________________________
改用小火加热后,橙红色会逐渐消失,消失的原因是(请用化学反应方程式表示):
______________________________________________________
(3)为了更好地控制反应温度,除用图示的小火加热,还可采用的加热方式是__________。
(4)步骤⑤反应结束后,将U形管中的混合物倒入分液漏斗中,静置,待液体分层后, 弃去____________(填“上层”或“下层”)液体。为了除去粗产品中的杂质,可用下列试剂中的_____________(填序号)
A. 氢氧化钠稀溶液 B. 碳酸钠稀溶液
C. 硝酸银溶液 D. 四氯化碳
探究二:学习小组在进行溴乙烷与NaOH乙醇溶液的反应实验中,观察到有气体生成。他们设计了两种不同的方法分别检验该气体,实验装置如图

请回答:
(5)图1中,试管1的作用是:________________________________;
图2中发生的反应是:________________________________(用化学方程式表示)。
某研究性学习小组进行溴乙烷的制备及性质探究实验。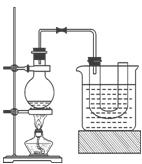
探究一:该小组制备溴乙烷的步骤如下:
① 向装置图所示的U形管和大烧杯中加入冷水;
② 在小烧杯中按照一定比例配制乙醇、水、浓硫酸的混合液;
③ 向装置图所示的圆底烧瓶中加入一定量研细的溴化钠粉末和少量碎瓷片;
④ 将冷却至室温的混合液转移到圆底烧瓶中,加热;
⑤ 制取溴乙烷。
回答下列问题:
(1)步骤②向乙醇和水中缓缓加入浓硫酸时,小烧杯要置于冷水中冷却,除了避免硫酸小液滴飞溅外,更主要的目的是:_____________________________________
(2)步骤④加热片刻后,烧瓶内的混合物出现橙红色,出现这种现象的原因是(请用化学反应方程式表示):____________________________________________________
改用小火加热后,橙红色会逐渐消失,消失的原因是(请用化学反应方程式表示):
______________________________________________________
(3)为了更好地控制反应温度,除用图示的小火加热,还可采用的加热方式是__________。
(4)步骤⑤反应结束后,将U形管中的混合物倒入分液漏斗中,静置,待液体分层后, 弃去____________(填“上层”或“下层”)液体。为了除去粗产品中的杂质,可用下列试剂中的_____________(填序号)
| A.氢氧化钠稀溶液 | B.碳酸钠稀溶液 |
| C.硝酸银溶液 | D.四氯化碳 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com