
题目列表(包括答案和解析)
实验室配制500 mL 0.2 mol·L-1的FeSO4溶液,操作步骤有:①在天平上称取27.8 g绿矾,把它放在烧杯里,用适量的蒸馏水把它完全溶解。②把制得的溶液小心地注入500 mL容量瓶中。③继续向容量瓶中加入蒸馏水,至液面距刻度1 cm—2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。④用少量蒸馏水洗涤烧杯和玻璃棒2—3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。⑤将容量瓶塞紧,充分摇匀。请填写下列空白:
(1)操作步骤的正确顺序为(填序号):____________________________________________。
(2)本实验用到的基本仪器有:__________________________________________________。
(3)若俯视刻度,对所配制溶液浓度的影响是______________(填“偏低”“偏高”或“无影响”)。
(4)若没有进行④的操作,其影响是________________________________________________。
(5)若实验中出现了下列情况应如何处理:加蒸馏水时不慎超过了刻度,应________________,向容量瓶中转移溶液时(实验步骤②)不慎有液滴溅在容量瓶外面,应____________________。
实验室配制500 mL 0.2 mol/L的FeSO4溶液,实验操作步骤有:
①、在天平上称出27.8 g绿矾(FeSO4?7H2O),把它放在烧杯里,用适量的蒸馏水使它完全溶解。
②、把制得的溶液小心地注入500 mL容量瓶中。
③、继续向容量瓶中加蒸馏水至液面距刻度1~2 cm处。改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑤将容量瓶塞塞紧,充分摇匀
请填写下列空白(1)操作步骤和正确顺序为(填序号)____________________。
(2)本实验用到的玻璃仪器有____________________________。
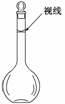
(3)某同学观察液面的情况如图所示,对所配溶液浓度有何影响?会_____________
(填“偏高”、“偏低”或“无影响”);
若没有进行操作步骤④所配溶液浓度会_____________
(填“偏高”、“偏低”或“无影响”)。
(4)若实验过程中加蒸馏水时不慎超过了刻度,应_______________。
填写下列空白:
(1)称量绿矾的总质量是_____________。
(2)操作步骤的正确顺序是(填序号)__________。
(3)本实验使用到的仪器是_____________。
(4)若没有进行④操作,会使结果_____________。
(5)在进行②操作时,不慎有液体溅出,应怎样处理?_________________________________。
实验室配制500 mL 0.2 mol·L-1的FeSO4溶液,实际操作步骤有:①在天平上称量一定量的绿矾(FeSO4·7H2O),放入烧杯,加水溶解.②把制得的溶液小心地注入500 mL容量瓶中.③继续向容量瓶中加水至距刻度1-2 cm处,改用胶头滴管加水至刻度.④用少量水洗涤烧杯和玻璃棒2-3次,将每次洗涤液转入容量瓶,并摇匀.⑤将容量瓶塞塞紧,充分摇匀.
填写下列空白:
(1)称量绿矾的总质量是________.
(2)操作步骤的正确顺序是(填序号)________.
(3)本实验使用到的仪器是________.
(4)若没有进行④操作,会使结果________.
(5)在进行②操作时,不慎有液体溅出,应怎样处理?__________________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com