
题目列表(包括答案和解析)
某学生做钠在氯气中燃烧的实验时,使用了崭新的铜制燃烧匙,当钠燃烧时,除了观察到有白烟外,还有少量棕色的烟,能说明这个现象的化学方程式为
__________________,___________________________;将上述反应得到的固体溶于水后再加入NaOH溶液,产生少量蓝色沉淀,该反应的离子方程式为:
__________________________。
某学生做钠在氯气中燃烧的实验时,使用了崭新的铜制燃烧匙,当钠燃烧时,除了观察到有白烟外,还有少量棕色的烟,能说明这个现象的化学方程式为________,________;将上述反应得到的固体溶于水后再加入NaOH溶液,产生少量蓝色沉淀,该反应的离子方程式为:________.

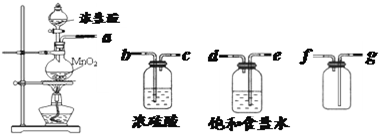
| 实验方法 | 实验现象 | 结论 |
| 在溶液中加 KSCN溶液 |
固体物质中有FeCl3 | |
| 向a溶液中滴加 酸性KMnO4溶液 |
KMnO4溶液色 不褪色 |
固体物质中不含______ |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com