
题目列表(包括答案和解析)
25℃时,氢氧化钠的溶解度为40 g,向100 g 水中投入一定量金属钠,反应完全后,恢复至25℃,此时溶液恰好处于饱和状态且无晶体析出,则投入的钠的质量约为( )
A.23.5 g ![]() 11.5 g C.19.5 g D. 23.0 g
11.5 g C.19.5 g D. 23.0 g
25℃时,氢氧化钠的溶解度为40 g.向100 g 水中投入一定量金属钠,反应完全后,恢复至25℃,此时溶液恰好处于饱和状态且无任何晶体析出,则投入的钠的质量约为
A.23.5 g B.11.5 g C.23.0 g D.19.5 g
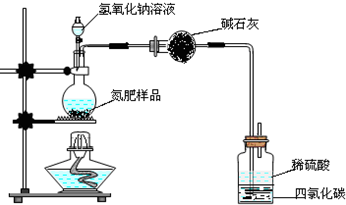 某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:
某氮肥硫酸铵中混有硫酸氢铵.为测定该氮肥的含氮量,一化学研究性学习小组取一定量氮肥样品,研磨使其混合均匀,备用.已知:| 氢氧化钠溶液体积/mL | 40.00mL | ||
| 样品质量/g | 7.750 | 15.50 | 23.25 |
| 氨气质量/g | 1.870 | 1.870 | 1.700 |
硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2Mg0.B203.H20、 Si02及少量Fe304、CaCO3, Al2O3)为原料生产硼酸的工艺流程如下:
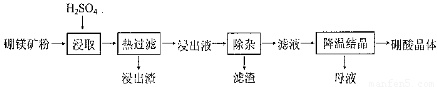
已知:H3BO3在200C、400C、600C、1000C时的溶解度依次为5.0 g、8.7 g、14.8 g、 40. 2 g。Fe3 +、Al3 +、Fe2 +和Mg2 +以氢氧化物形式完全沉淀时,溶液的pH分别为3. 2、 5.2、9.7和 12.4。
(1)由于矿粉中含CaC03,为防止“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施是: ??????????????????????????????????????????????????????????????????????????????????? 。
(2)“浸出液”显酸性,含H3B03和Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H202和Mg0,除去的杂质离子是_______。H2O2的作用是____________________________________________ (用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的是_____________________________________。
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如下图,且溶 液的沸点随压强增大而升高。为了从“母液”中充分回收MgS04·H20,应采取的 措施是将“母液”蒸发浓缩,____________
(5)硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)  [B(OH)4]-(aq)+H+(aq)?? K=5.7×10-10(298K)
[B(OH)4]-(aq)+H+(aq)?? K=5.7×10-10(298K)
计算25℃时0.7mol·L-1 硼酸溶液中H+的浓度。(写出计算过程)
(6)已知298K时:
化学式 | 碳酸 | 醋酸 |
电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
下列说法正确的是??????????????? 。
A.碳酸钠溶液滴入硼酸中能观察到有气泡产生
B.碳酸钠溶液滴入醋酸中能观察到有气泡产生
C.等浓度的碳酸和硼酸溶液比较,pH:前者>后者
D.等浓度的碳酸钠和醋酸钠溶液比较,pH:前者>后者
硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2Mg0.B203.H20、Si02及少量Fe304、CaCO3, Al2O3)为原料生产硼酸的工艺流程如下: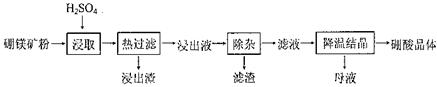
已知:H3BO3在200C、400C、600C、1000C时的溶解度依次为5.0 g、8.7 g、14.8 g、40. 2 g。Fe3 +、Al3+、Fe2 +和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3. 2、 5.2、9.7和 12.4。
(1)由于矿粉中含CaC03,为防止“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施是: 。
(2)“浸出液”显酸性,含H3B03和Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H202和Mg0,除去的杂质离子是_______。H2O2的作用是____________________________________________ (用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的是_____________________________________。
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如下图,且溶 液的沸点随压强增大而升高。为了从“母液”中充分回收MgS04·H20,应采取的 措施是将“母液”蒸发浓缩,____________
(5)硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)  [B(OH)4]-(aq)+H+(aq) K=5.7×10-10(298K)
[B(OH)4]-(aq)+H+(aq) K=5.7×10-10(298K)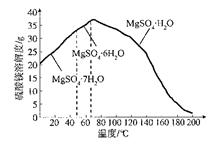
计算25℃时0.7mol·L-1硼酸溶液中H+的浓度。(写出计算过程)
(6)已知298K时:
| 化学式 | 碳酸 | 醋酸 |
| 电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com